解答:
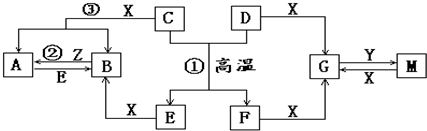
解:Ⅰ.图中D、E、Z是单质,其余均是化合物.且知E为日常常用金属;D元素的原子最外层电子数与电子层数相等,C+D=E+F是置换反应,推断高温下为铝热反应,推断D为Al,E为Fe,F为Al
2O
3;Z、Y是氯碱工业的产品,由图中Al、Al
2O
3和Y反应可推断,Y为NaOH;得到Z为Cl
2,X为HCl,反应均在水溶液中进行,所以推断得到G为NaAlO
2,M为AlCl
3,B为FeCl
2,A为FeCl
3,则C为Fe
3O
4,
(1)FeCl
3晶体的熔点282℃、沸点315℃,加热至100℃左右会升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂,应为分子晶体,升华时克服的作用力类型为分子间作用力(范德华力),
故答案为:分子;分子间作用力(范德华力);
(2)反应①为铝热反应,方程式为8Al+3Fe
3O
4 4Al
2O
3+9Fe,反应③为Fe
3O
4和酸的反应,离子方程式为Fe
3O
4+8H
+=Fe
2++2Fe
3++4H
2O,若将Fe
3O
4溶于稀硝酸中,因含有+2价铁,则发生氧化还原反应,反应的化学方程式为3Fe
3O
4+28HNO
3=9Fe(NO
3)
3+NO↑+14H
2O,
故答案为:8Al+3Fe
3O
4 4Al
2O
3+9Fe;Fe
3O
4+8H
+=Fe
2++2Fe
3++4H
2O;3Fe
3O
4+28HNO
3=9Fe(NO
3)
3+NO↑+14H
2O;
Ⅱ.短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,X有2个电子层,最外层电子数为6,故X为O元素,W与X属于同一主族,故W为S元素,Y原子的最外层只有2个电子,原子序数大于O元素,故Y处于第三周期,故Y为Mg元素,T单质可制成半导体材料,T为Si元素,则Z为Al,
(1)O
2-、Mg
2+、Al
3+ 具有相同的核外电子排布,核电荷数越大,则离子半径越小,应为O
2->Mg
2+>Al
3+,故答案为:O
2->Mg
2+>Al
3+;
(2)非金属性S>Si,元素的非金属性越强,对应的氢化物越稳定,则H
2S较稳定,故答案为:H
2S;
(3)①Mg、Al 是活泼金属易被氧化,故熔炼制备镁铝合金(Mg
17Al
12)时常需通入氩气作保护气,目的是防止Mg、Al被空气氧化,
故答案为:防止Mg、Al被空气氧化;
②36.6gMg
17Al
12的物质的量为
=0.05mol,反应的方程式为Mg
17Al
12+17H
2═17MgH
2+12Al,根据方程式知,1molMg
17Al
12完全吸氢后生成17molMgH
2和12molAl,根据原子守恒知与酸反应后吸收的氢气完全被放出,吸收的氢气的物质的量是17mol,镁与盐酸完全反应放出n(H
2)=n(Mg)=17mol,12mol铝与足量盐酸反应放出的n(H
2)=1.5n(Al)=18mol,所以共放出n(H
2)=17mol+17mol+18mol=52mol,
则36.6gMg
17Al
12与盐酸反应生成氢气的体积为0.05×52mol×22.4/mol=58.24L,
故答案为:58.24.



 我国著名化学家傅鹰告诫我们“化学给人以知识,化学史给人以智慧.”回顾苯的结构的探索历程,曾有人提出两种立体结构就上述两种立体结构回答下列有关问题:
我国著名化学家傅鹰告诫我们“化学给人以知识,化学史给人以智慧.”回顾苯的结构的探索历程,曾有人提出两种立体结构就上述两种立体结构回答下列有关问题: 如图是苯与溴发生反应并进行产物检验的反应装置,具体实验过程如下:
如图是苯与溴发生反应并进行产物检验的反应装置,具体实验过程如下: