
ClO2是一种消毒杀菌剂,实验室可通过下列反应制得ClO2:
2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法中正确的是
A.KClO3在反应中得到电子
B.ClO2是氧化产物
C.H2C2O4被还原
D.1molKClO3发生反应,转移的电子数为2NA
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源:2016-2017学年广东省高二上大考二化学卷(解析版) 题型:实验题
Ⅰ.某兴趣小组利用下图装置测定某硫酸工厂排放尾气中二氧化硫的含量,图中气体流量计B用于准确测量通过的尾气体积。将尾气通入一定体积已知浓度的碘水中测定SO2的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A。
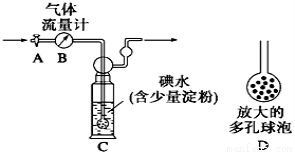
(1) C中导管末端连接一个多孔球泡D,可以提高实验的准确度,其理由是_________________。
(2)C中发生反应的离子方程式 。
(3)C中溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量 (填“偏高”、“ 偏低”或“无影响”)。
偏低”或“无影响”)。
Ⅱ.实验室常用Na2SO3固体与浓硫酸反应制取SO2 :
(4)现有已制得SO2的饱和溶液,请利用此溶液(其他试剂任选),设计一个简单实验,比较SO2与Fe2+ 还原性的强弱(要求:写出实验步骤、现象和结论) 。
(5)某研究小组测定部分变质的Na2SO3固体样品中Na2SO3的含量:
① 取a克Na2SO3固体样品配制成100mL溶液,取10.00mL该溶液于锥形瓶 中,加入几滴淀粉溶液作指示剂,0.0100mol/L碘水进行滴定,滴定终点现象为 ,记录数据,重复滴定2次,平均消耗碘水20.00mL。
中,加入几滴淀粉溶液作指示剂,0.0100mol/L碘水进行滴定,滴定终点现象为 ,记录数据,重复滴定2次,平均消耗碘水20.00mL。
② 计算:样品中亚硫酸钠的质量分数为 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省菏泽市高一上学期期中化学试卷(解析版) 题型:填空题
某化工厂用氯气与石灰乳生产漂白粉.该厂出厂产品说明书如下:

(1)漂白粉长期露置在空气中会变质,写出漂白粉变质过程中涉及的2个化学反应方程式:
① ;
② .
(2)某实验室研究员将完全变质后的漂白粉溶于水,往其中加入足量稀硝酸,收集到标准状况下448mL气体,则该漂白粉中所含有效成份的质量为 .(假设漂白粉中的其它成份不与稀硝酸反应)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省菏泽市高一上学期期中化学试卷(解析版) 题型:选择题
将一小块钠投入盛有5mL饱和CuSO4溶液的试管里,不可能观察到的现象是( )
A.钠熔成小球并在液面上游动 B.有气体生成
C.试管底部有红色物质生成 D.溶液变浑浊
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北宜昌金东方中学、三峡高中高一11月月考化学卷(解析版) 题型:推断题
在四个脱落标签的试剂瓶中,盛有盐酸、Ba(OH)2溶液、NaHCO3溶液、MgSO4溶液,为了鉴别各瓶中的试剂将它们分别编号为A、B、C、D并两两混合,其实验现象为A+B混合产生无色气体;B+C混合产生白色沉淀;C+D产生白色沉淀;A+C混合 无明显变化。
无明显变化。
⑴试剂B是 ,试剂D是 ;
⑵少量B与足量的C反 应的离子方程式为 ;
应的离子方程式为 ;
⑶C溶液与D溶液反应的离子方程式为 ;
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北宜昌金东方中学、三峡高中高一11月月考化学卷(解析版) 题型:选择题
实验室有一瓶溶液,标签上标有“BaCl2 0.2 mol·L-1”的字样,下面对该溶液的叙述正确的是
A.配制500mL该溶液,可将0.1 mol BaCl2溶于500mL水中
B.Ba2+和Cl-的物质的量浓度都是0.1 mol·L-1
C.将该瓶溶液稀释一倍,则所得溶液的c(Cl-)为0.2 mol·L-1
D.从试剂瓶中取该溶液的一半,则所取溶液的物质的量浓度为0.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北宜昌金东方中学、三峡高中高一11月月考化学卷(解析版) 题型:选择题
如右图两集气瓶体积相等,在同温、同压时瓶内气体的关系一定正确的是
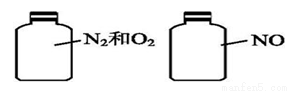
A.所含原子数相等 B.气体密度相等
C.气体质量相等 D.摩尔质量相等
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高二12月月考化学卷(解析版) 题型:选择题
在K2CrO4溶液中存在着如下平衡2CrO42-+ 2H+ Cr2O72-+ H2O, K=1×1014。若用0.05mol K2Cr2O7配制成1LK2CrO4溶液,其中c(Cr2O72-)<10-5mol/L,则所配溶液的pH
Cr2O72-+ H2O, K=1×1014。若用0.05mol K2Cr2O7配制成1LK2CrO4溶液,其中c(Cr2O72-)<10-5mol/L,则所配溶液的pH
A.>7 B.<7 C.=7 D.无法确定
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高二上期中化学卷(解析版) 题型:填空题
含氮化合物在生产、生活和科研中有着广泛的应用。
(1)工业上采用NH3为还原剂处理烟气(假设烟气中的NO和NO2的物质的量相等,且反应产物为无毒气体),测量逸出气体中氮氧化物含量,从而确定烟气脱氮率。如图,下列列说法正确的是(填写下列字母编号)
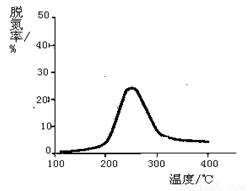
a.相同条件下,改变压强对脱氮率有影响
b.曲线最高点表示此时平衡转化率最高
c.相同条件下,加入不同的催化剂能够改变反应物的转化率
d.上述反应的化学方程式为:NO+NO2+2NH3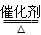 2N2
2N2 3H2O
3H2O
(2)已知: 2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g) △H=-43.0KJ·mol-1
CO(NH2)2(s)+H2O(g) △H=-43.0KJ·mol-1
—定条件下,将2molNH3和1molCO2充入容积为2L的密闭容器中发生反应。反应进行2min时,放出热量21.5kJ,则2min内该反应的反应速率υ(NH3)= ,此时混合气体中NH3的体积分数为 。
(3)在25℃下,将a mol•L-1的NH4NO3溶液与0.01mol•L-1的NaOH等体积混合,反应平衡时,测得溶液pH=7,则NH4NO3溶液的物质的量浓度a___________0.01mol•L-1(填“>”、“<”或“=”);滴加NaOH的过程中水的电离平衡将 (填“正向”、“不”或“逆向”)移动。请你设计实验,比较NH3 • H2O的电离程度和NH4NO3的水解程度大小 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com