
下列物质属于 电解质的是( )
电解质的是( )
①盐酸②CO2③熔融的KNO3④稀硫酸⑤NaHCO3⑥NaOH⑦Cu⑧酒精
A.①③⑤⑥ B.①③④⑤⑥ C.①④⑤⑥ D.③⑤⑥
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源:2017届辽宁省沈阳东北育才学校高三上期中模拟化学卷(解析版) 题型:填空题
氮氧化物(NOx)种类很多,造成大气污染的主要是NO和NO2,研究它们的综合利用有重要意义。
(1)NO可通过氧化-还原法转化为N2,转化关系如下:
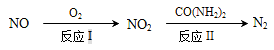
反应Ⅰ的化学方程式是_______;反应Ⅱ的还原剂是_______。
(2)NO还可与C在一定条件下反应得到无污染的气 体。NO与C在一定条件下反应的化学方程式是_______。
体。NO与C在一定条件下反应的化学方程式是_______。
(3)NO也可直接用活性铁粉转化为N2。
已知:N2(g)+O2(g)=2NO(g) △H1
4Fe(s)+3O2(g)=2Fe2O3(s) △H2
则6NO(g)+4Fe(s)=2Fe2O3(s)+3N2(g) △H =___________(用“△H1”、“△H2”表示)。
(4)NO2可电解制备绿色硝化试剂N2O5。下图是其原理示意图。
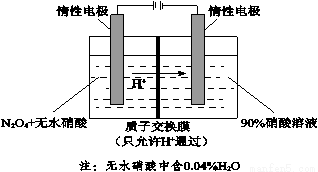
① 阳极电解液中的N2O4由NO2降温转化得到,降温的原因是_______________。
② 阳极区生成N2O5的电极反应式是_______________。
③ 阴极区得到一种可循环利用的物质,其化学式是_______________。
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上月考三化学卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值,下列有关说法正确的是( )
A.在1L 0.1mol/L的Na2CO3溶液中,阴离子总数小于0.1NA
B.将1 mol NH4NO3溶于 稀氨水中使溶液呈中性,溶液中NH4+数目为NA
稀氨水中使溶液呈中性,溶液中NH4+数目为NA
C.标准状况下,2.24L甲醇中含有C—H键的数目为0.3NA
D.将1mol Cl2通入水中,HClO、Cl-、ClO-粒子数之和为2NA[来
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一上半期考试化学卷(解析版) 题型:选择题
下列说法正确的是( )
A.22.4LN2中一定含有6.02×1023个氮分子
B.18 gH2O在标准状况下的体积是22.4 L
gH2O在标准状况下的体积是22.4 L
C.在常温常压下,20mLNH3与60mL O2所含的分子个数比为1∶3
D.将40gNaOH溶于1L水中,所得溶液中NaOH的物质的量浓度为1 mol/L
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一上半期考试化学卷(解析版) 题型:选择题
在无色透明的强酸性溶液中,能大量共存的离子组是( )
A.K+、SO42-、CO32-、Na+ B.Ca2+、NO3-、Al3+、Cl-
C.Fe3+、Cu2+、K+、OH- D.MnO4-、K+、SO42-、Na+
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省等三校高一上期中化学卷(解析版) 题型:实验题
分某同学帮助水质检测站配制490 mL 0.5 mol • L-1NaOH溶液以备使用。
(1) 该同学应选择__________mL的容量瓶。
(2) 应用托盘天平准确称量____________g NaOH固体。
(3) 配制过程如图乙所示,则图甲操作应在图乙中的___________ (填字母)之间。
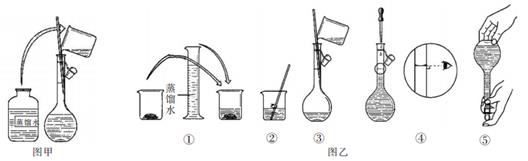
A.①与② B.②与③ C.③与④
(4)若在配制过程中出现下列情况,会使所配制NaOH溶液的浓度偏低的是___________(填字母)。
A.转移溶液后,未洗涤烧杯和玻璃棒就直接定容
B.定容时俯视
C.配制溶液所用的容量瓶洗净后没有烘干
D.NaOH固体在烧杯中溶解后,立即将溶液转移到容量瓶内,并接着进行后续操作
E.定容摇匀后,发现液面低于刻度线,再加入蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省等三校高一上期中化学卷(解析版) 题型:选择题
下列每组分别给出了两个量,不可以求出相应物质的量的是
A | B | C | D |
物质微粒数 | 溶液的质量分数 | 标准状况下气体的摩尔体积 | 物质的质量 |
阿伏加德罗常数 | 溶液体积 | 标准状况下气体的体积 | 物质的摩尔质量 |
查看答案和解析>>
科目:高中化学 来源:2017届西藏山南二中高三上11月月考化学试卷(解析版) 题型:选择题
判断下列氧化还原反应不能发生的是( )
A.Cl2+2Br-==2Cl-+Br2 B.Cl2+2I-==2Cl-+I2
C.I2+2Br-==2I-+Br2 D.Br2+2I-==2Br-+I2
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三上月考四化学卷(解析版) 题型:简答题
钴(Co)及其化合物在工业上有广泛应用。为从某工业废料中回收钴,某学生设计流程如下(废料中含有Al、Li、Co2O3和Fe2O3等物质)。
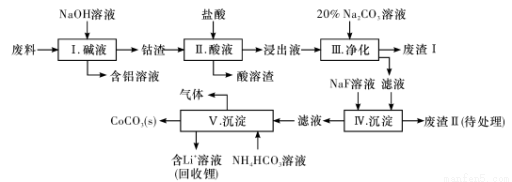
已知:①物质溶解性:LiF、CoCO3难溶于水,Li2CO3微溶于水;
② Co2O3有强氧化性,能氧化盐酸;
③ 部分金属离子形成氢氧化物沉淀的pH见下表:
Fe3+ | Co2+ | Co3+ | Al3+ | |
pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
请回答:
(1) 步骤I中得到含铝溶液的反应的离子方程式是________________。
(2) 步骤D中加人盐酸的作用是________________。
(3) 步骤III中Na2CO3溶液的作用是调节溶液的PH,应使溶液的pH控制在_____(填范围),废渣I中的成分有________________。
(4) 步骤V中产生CoCO3的离子方程式是________________。
(5) 滤渣II用硫酸处理后用三室式电渗析法电解可得LiOH溶液和稀硫酸。则离子交换膜c为__________(填“阴”或“阳”)离子交换膜,随着电解的进行,阴极区pH将_________(填“增大”、“减小”或“不变”)。
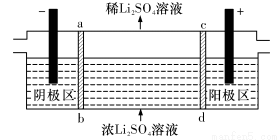
(6) 向所得LiOH溶液中加入NH4HCO3即可得到Li2CO3。工业上以碳酸锂和碳酸钴在空气中高温煅烧制备锂离子电池的正极材料钴酸锂 (LiCoO2)时,还会产生一种三原子构成的直线型气体分子,该分子的电子式为_______________,写出工业上用上述方法制备钴酸锂的化学反应方程式___________________。
(7) 某锂离子充电时电池的总反应为C6+ LiCoO2==LixC6+Li1-xCoO2,该锂离子电池放电时正极的电极反应式为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com