
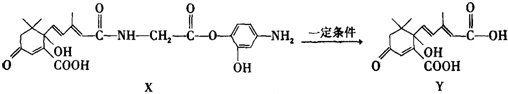
| A. | 1mol X与足量NaOH溶液反应,最多消耗4mol NaOH | |
| B. | Y既可以与FeCl3溶液发生显色反应,又可使酸性KMnO4溶液褪色 | |
| C. | X可以发生氧化、取代、酯化、加聚、缩聚反应,并能与盐酸反应生成有机盐 | |
| D. | X结构中有2个手性碳原子 |
分析 A.羧基、酯基水解生成的羧基和酚羟基、酚羟基、二肽水解生成的羧基都能和NaOH溶液反应;
B.Y中含有碳碳双键,但不含酚羟基;
C.X中含有羰基、碳碳双键、羧基、醇羟基、肽键、酯基、酚羟基、氨基,具有酮、烯烃、羧酸、醇、二肽、酯、酚、胺的性质;
D.连接四个不同原子或原子团的C原子为手性碳原子.
解答 解:A.羧基、酯基水解生成的羧基和酚羟基、酚羟基、二肽水解生成的羧基都能和NaOH溶液反应,所以1mol X与足量NaOH溶液反应,最多消耗5mol NaOH,故A错误;
B.Y中含有碳碳双键,所以能被酸性高锰酸钾溶液氧化,但不含酚羟基,所以不能和氯化铁溶液发生显色反应,故B错误;
C.X中含有羰基、碳碳双键、羧基、醇羟基、肽键、酯基、酚羟基、氨基,具有酮、烯烃、羧酸、醇、二肽、酯、酚、胺的性质,所以能发生氧化、取代、酯化、加聚、缩聚反应,并能与盐酸反应生成有机盐,故C正确;
D.连有4个不同原子或原子团的碳原子为手性碳原子,则X中只有与-OH相连的C为手性碳原子,故D错误.
故选C.
点评 本题考查有机物的官能团及其性质,注意有机物的结构和性质的关系,熟悉常见的官能团及醇、烯烃、羧酸、酯的性质即可解答,题目难度不大,选项D为解答的难点.


科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温度不变,缩小体积,CIF的转化率增大 | |
| B. | 温度不变,增大体积,CIF3的产率提高 | |
| C. | 升高温度,增大体积,有利于平衡向正反应方向移动 | |
| D. | 降低温度,体积不变,F2的转化率降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ④⑤⑥ | C. | ③④⑤ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑦⑧⑨ | B. | ③④⑤⑦⑧ | C. | ②③⑥⑦⑨ | D. | ④⑤⑥⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用润湿的pH试纸测稀酸溶液的pH,测定值偏大 | |
| B. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 | |
| C. | 用标准酸液滴定未知碱液时,若酸式滴定管未润洗,则测定结果偏大 | |
| D. | 测定中和反应的反应热时,将碱缓慢倒入酸中,所测结果偏低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com