
【题目】建构数学模型来研究化学问题,既直观又简洁,下列建构的数轴模型正确的是( )
A.钠在氧气中燃烧,钠的氧化产物:![]()
B.铁在Cl2中燃烧,铁的氧化产物:![]()
C.A1C13溶液中滴加NaOH溶液后体系中铝元素的存在形式:![]()
D.FeI2溶液中通入Cl2,铁元素存在形式:![]()
【答案】D
【解析】
试题分析:A、钠在氧气中燃烧只生成Na2O2,故错误;B、铁在氯气燃烧,无论氯气过量与否,生成的都是FeCl3,故错误;C、Al3 + + 3OH- = Al(OH)3↓,Al3 + + 4OH- = AlO2- + 2H2O,n(Al3 + )/n(OH-)的数值是1/3、1/4,不是3、4,故错误;D、I-的还原性强于Fe2 + ,先发生2I- + Cl2 = 2Cl- + I2,然后发生2Fe2 + + Cl2 = 2Fe3 + + 2Cl-,当n(Cl2)/n(FeI2)≤1时,铁元素以Fe2 + 形式存在,当n(Cl2)/n(FeI2)≥3/2时,铁元素以Fe3 + 形式存在,故正确。


科目:高中化学 来源: 题型:
【题目】下列有关物质的分离说法正确的是
A.检查是否漏水是滴定管、容量瓶、分液漏斗等仪器使用的第一步操作
B.碘水中加CCl4振荡静置后,上层为紫色,下层几乎为无色
C.可用加热法分离NH4Cl(s)和I2(s)
D.蒸馏、分馏和干馏都是利用组分沸点不同而分离的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝元素在自然界中主要存在于铝土矿(主要成分为A12O3,还含有Fe2O3、FeO、SiO2) 中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。
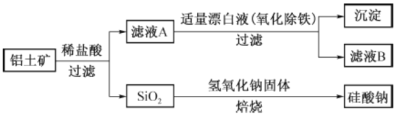
(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①该过程中涉及某氧化还原反应如下,请完成:
![]()
②检验滤液B中是否还含有铁元素的方法为: (注明试剂、现象)。
③将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为 (填代号)
A.氢氧化钠溶液 B.硫酸溶液 C.氨水 D.二氧化碳
④由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、冷却结晶、 (填操作名称)、洗涤。
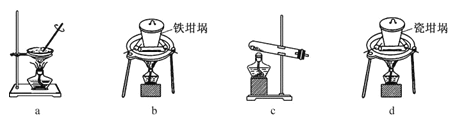
(2)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为 (填代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式正确的是( )
A. CH3OH(l)+![]() O2(g)===CO2(g)+2H2O(l);ΔH=" +725.8" kJ/mol
O2(g)===CO2(g)+2H2O(l);ΔH=" +725.8" kJ/mol
B. 2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l);ΔH= -1452 kJ/mol
C. 2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l);ΔH= -725.8 kJ/mol
D. 2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l);ΔH=" +1452" kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是电解CuCl2溶液的装置,其中c、d为石墨电极,则下列有关判断正确的是( )

A.a为负极,b为正极
B.d为阳极,c为阴极
C.电解过程中,d电极质量增加
D.电解过程中,氯离子浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ABCD在一定条件下的转化关系如图所示(反应条件已省略)其中,A是一种气态烃,在标准状况下的密度是1.25g·L-1,其产量是衡量一个国家石油化工发展水平的标志之一;C的分子式为C2H4O2;B和C在浓硫酸和加热的条件下发生反应,生成的有机物D有特殊的香味
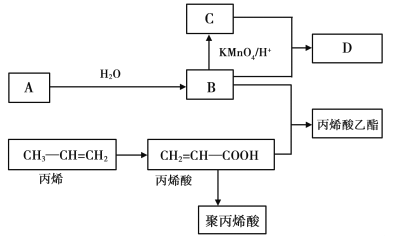
试回答下列问题:
(1)A的分子式为 ,丙烯酸分子结构中所含的官能团名称是 ,丙烯分子中最多有 个原子共平面
(2)丙烯酸乙酯可能发生的反应类型有
① 加成反应 ② 取代反应 ③ 加聚反应 ④ 中和反应
A.①③ B.①②③ C.①③④ D.①②③④
(3)写出聚丙烯酸的结构简式
(4)写出丙烯酸与B反应的化学方程式
(5)下列有关说法正确的是 (填编号)
A.D与丙烯酸乙酯互为同系物
B.B→C的转化是氧化反应
C.可以用酸性 KMnO4溶液鉴别 A和丙烯酸
D.蒸馏能分离B和C的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列原电池的装置图,回答问题:
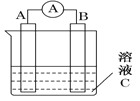
(1)若C为稀H2SO4溶液,电流表指针发生偏转,B电极材料为Fe且做负极,则A电极上发生的电极反应式为____________________;反应进行一段时间后溶液C的pH将________(填“升高”“降低”或“基本不变”)。
(2)若需将反应:Cu+2Fe3+===Cu2++2Fe2+设计成如上图所示的原电池装置,则负极A极材料为 ,正极B极材料为 ,溶液C为 。
(3)用CH4和O2组合形成的质子交换膜燃料电池的结构示意图如下:
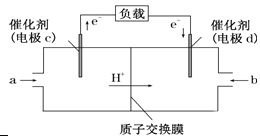
①则d电极是________(填“正极”或“负极”),c电极的反应方程式为:_____ 。
②若线路中转移2 mol电子,则上述燃料电池,消耗的O2在标况下的体积为______ L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com