
(16分)
Ⅰ、工业上用含有Cr2O72-和CrO42-的废水回收铬。其工艺流程如下:

已知:①2 CrO42-(黄色)+2H+  Cr2O72-(橙色)+ H2O;
Cr2O72-(橙色)+ H2O;
②常温下,Ksp【Fe(OH)3】=1.0×10-38,Ksp【Cr(OH)3】=1.0×10-32;
③当离子浓度小于1.0×10-5 mol·L-1时,认为沉淀完全。
(1)下列选项中能说明反应2 CrO42-(黄色)+2H+  Cr2O72-(橙色)+ H2O达平衡状态的是_______(填选项字母)。
Cr2O72-(橙色)+ H2O达平衡状态的是_______(填选项字母)。
A.Cr2O72-和CrO42-的浓度相同
B.2v(Cr2O72-)= v(CrO42-)
C.溶液的颜色不变
D.溶液的PH不变
(2)为防止FeSO4溶液变质,在保存时需加入的试剂为 (填试剂名称)
(3)过滤操作中需要用到的玻璃仪器有
(4)FeSO4溶液与溶液A发生反应的离子方程式为
(5)沉淀C的化学式为 ,pH2的范围为
Ⅱ、铝电池性能优越,铝一空气电池以其环保、安全而受到越来越多的关注,其原理如图所示。
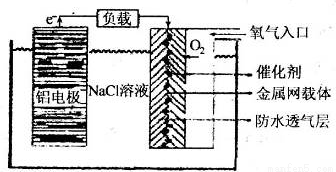
(6)该电池的总反应化学方程式为 ;
(7)某铝一空气电池的效率为50%,若用其作电源电解500mL的饱和NaCl溶液,电解结束后,所得溶液(假设溶液电解前后体积不变)中NaOH的浓度为0.3 mol·L-1,则该过程中消耗铝的质量为 。
(1)cd(各1分,共2分)
(2)铁粉 硫酸 (各1分,共2分)
(3)烧杯 漏斗 玻璃棒 (2分,只要有错不得分)
(4)Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O (2分)
(5)Fe(OH)3 (2分) >5 (2分)
(6)4Al+3O2+6H2O=4Al(OH)3 (2分)
(7)2.7g (2分)
【解析】
试题分析:
(1)2 CrO42-(黄色)+2H+  Cr2O72-(橙色)+ H2O达平衡状态时A.物质的平衡溶液与起始浓度与反应进行的程度有关,Cr2O72-和CrO42-的平衡浓度相同,不能判断是否达到平衡,故A错误。
Cr2O72-(橙色)+ H2O达平衡状态时A.物质的平衡溶液与起始浓度与反应进行的程度有关,Cr2O72-和CrO42-的平衡浓度相同,不能判断是否达到平衡,故A错误。
B. 2v(Cr2O72-)= v(CrO42-),没体现出正反应速率等于逆反应速率,不能判断是否平衡,故B错误。C.溶液的颜色不变,说明物质的浓度不再变化,说明反应达平衡状态。故C正确。D.溶液的pH不变,说明H+浓度不变,化学反应达平衡状态。故D正确。(2)为防止FeSO4溶液变质,在保存时需加入的试剂为铁粉防止氧化,加入硫酸防止亚铁离子水解变浑。(3)过滤操作中需要用到的玻璃仪器有烧杯 漏斗 玻璃棒 。(4)已知工业废水中含有和CrO42-在酸化过程中CrO42-转化为Cr2O72-,所以加入的FeSO4溶液与Cr2O72-溶液发生反应的离子方程式为r2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O 。(5)已知常温下,Ksp【Fe(OH)3】=1.0×10-38<Ksp【Cr(OH)3】=1.0×10-32;调节pH1使Fe3+生成Fe(OH)3沉淀而析出,调节pH2目的是使Cr3+转化为Cr(OH)3而析出。由C(Cr3+)c3(OH-)=1×10-32,当Cr3+沉淀完全时
c3(OH-)=1×10-32/C(Cr3+)=1×10-32/1.0×10-5 =1×10-27
c(OH-)=1×10-9,pH=5,pH2的范围为pH2>5.
Ⅱ、(6)铝一空气电池的总反应化学方程式为4Al+3O2+6H2O=4Al(OH)3;(7)某铝一空气电池的效率为50%,若用其作电源电解500mL的饱和NaCl溶液,电解结束后,所得溶液(假设溶液电解前后体积不变)中NaOH的浓度为0.3 mol·L-1,则生成NaOH的物质的量为0.15 mol。由原电池反应方程式与电解总方程式可得关系式:
Al----3e----3NaOH
27g 3mol
m(Al)×50% 0.15mol
解得: m(Al)=2.7g
考点:了解化学平衡建立的过程。理解外界条件(浓度、温度、压强、催化剂等)对反应速率和化学平衡的影响,认识并能用相关理论解释其一般规律。 了解难溶电解质的沉淀溶解平衡。了解溶度积的含义及其表达式,能进行相关的计算。解原电池和电解池的工作原理,能写出电极反应和电池反应方程式。


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源:2014-2015学年上海市静安区高三上学期期末教学质量检测化学试卷(解析版) 题型:填空题
氢是宇宙中最丰富的元素,为一切元素之源。
23.1.H原子的电子排布式是“1s1”,该式子未表明电子运动状态的方面是 (选填编号)。
a.电子层 b.电子亚层
c.电子云的伸展方向 d.电子的自旋
24.2.金属锂与氢气在一定条件下能直接化合生成 LiH,以下事实能说明LiH是离子化合物的是 (选填编号)。
a.H为-1价 b.熔融状态能导电 c.加热到600℃不分解
LiH的电子式为 。
核外有2个电子的简单阴、阳离子有若干种,试比较它们半径的大小 。
25.3.非金属元素R的气态氢化物的化学式为H8-nR,则R的最高氧化物的化学式为 。
26.4.根据下表中的键能数据,写出氮气、氢气合成氨气的热化学方程式 。
在合成氨的工业生产中,科学家在努力寻找活性温度更低的新催化剂,简述其意义 。
共价键 | 键能(KJ/ mol) |
N≡N | 946 |
H-H | 436 |
H-N | 391 |
27.5.钯(Pd)是优良的储氢金属:2Pd (s)+xH2(g) 2PdHx (s) +Q(Q>0)
2PdHx (s) +Q(Q>0)
通常状况下,x的最大值为0.8,为使x>0.8可采取的措施是 ;为使PdHx 产生H原子并在固体中快速流动,可采取的措施是 (选填编号)。
a.升温 b.减压 c.及时移走金属钯
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省益阳市高三上学期期中考试化学试卷(解析版) 题型:选择题
将15g两种金属的混合物投入足量的盐酸中,反应完全后得到H2 11.2L(标准状况)该混合物的组成可能是
A.钠和铁 B.镁和铜 C.铝和镁 D.锌和铁
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高三12月月考化学试卷(解析版) 题型:选择题
镁粉是制备焰火的原料,工业上通过冷却镁蒸气制得镁粉。下列气体中可以用冷却镁蒸气的是
A.空气 B.二氧化碳 C.氧气 D.氩气
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高三12月月考化学试卷(解析版) 题型:选择题
在下列条件下,能大量共存的微粒组是
化学式 | 电离常数(25℃) |
HClO | Ki=3.0ⅹ10-8 |
H2CO3 | Ki1=4.3ⅹ10-7 Ki2=5.6ⅹ10-11 |
A.c(H+)=1×10-14mol/L的溶液:K+、Na+、AlO2-、S2O32-
B.上表提供的数据下:HClO 、HCO3-、ClO-、CO32-
C.能与Al反应生成H2的溶液:NH4+、Ca2+、NO3-、I-
D.中性的溶液中:CO32-、Na+、SO42-、AlO2-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高三1月练习理综化学试卷(解析版) 题型:选择题
高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸钠(Na2FeO4)的装置如图所示。下列说法正确的是

A.铁是阳极,电极反应为Fe-2e-+2OH-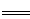 Fe(OH)2
Fe(OH)2
B.电解一段时间后,镍电极附近溶液的pH减小
C.每制得1mol Na2FeO4,理论上可以产生67.2L气体
D.若离子交换膜为阴离子交换膜,则电解结束后左侧溶液中含有FeO42-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省等五校高三上学期第二次联考理综化学试卷(解析版) 题型:填空题
[化学—选修2:化学与技术](15分)
将海水淡化与浓海水资源化结合起来是综合利用海水的重要途径之一。一般是先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺提取其他产品。
回答下列问题:
(1)下列改进和优化海水综合利用工艺的设想和做法可行的是 (填序号)。
①用混凝法获取淡水 ②提高部分产品的质量
③优化提取产品的品种 ④改进钾、溴、镁的提取工艺
(2)采用“空气吹出法”从浓海水中吹出Br2,并用纯碱吸收。碱吸收溴的主要反应是Br2+Na2CO3+H2O→NaBr + NaBrO3+NaHCO3,吸收1mol Br2时,转移的电子数为 mol。
(3)海水提镁的一段工艺流程如下图:
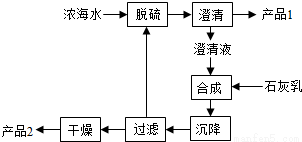
 浓海水的主要成分如下:
浓海水的主要成分如下:
离子 | Na+ | Mg2+ | Cl- | SO42- |
浓度/g/L | 63.7 | 28.8 | 144.6 | 46.4 |
该工艺过程中,脱硫阶段主要反应的离子方程式为 ,产品2的化学式为 ,1L浓海水最多可得到产品2的质量为 g。
(4)采用石墨阳极、不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为 ;电解时,若有少量水存在会造成产品镁的消耗,写出有关反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高三第五次调研考试化学试卷(解析版) 题型:选择题
常温下,下列有关醋酸的叙述中不正确的是
A.pH=5.6的由CH3COOH与CH3COONa组成的混合溶液中: c(Na+)<c(CH3C00-)
B.将PH=a的醋酸稀释为pH=a+1的过程中,C(OH-)不断增大
C.等体积pH=a的醋酸与pH=b的NaOH溶液恰好中和时,a+b=14
D.浓度均为0.1 mol·L-1的CH3COOH溶液和氨水等体积混合后:
查看答案和解析>>
科目:高中化学 来源:2014-2015黑龙江省高二上学期期末考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A、水晶是无色透明的晶体,可以制成硅太阳能电池
B、将FeCl3饱和溶液滴入沸水中,可以立即得到Fe(OH)3胶体
C、盛装NaOH溶液的试剂瓶用橡胶塞,不用玻璃塞
D、不能通过丁达尔效应来鉴别Fe(OH)3胶体和CuSO4溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com