
 Cu2S是火法炼铜一种重要的原料,下面是由Cu2S冶炼铜及制取CuSO4•5H2O的流程图:
Cu2S是火法炼铜一种重要的原料,下面是由Cu2S冶炼铜及制取CuSO4•5H2O的流程图:分析 (1)化合物中各元素化合价的代数和为0;依据流程中Cu2S与O2反应得到Cu写出方程式即可;
(2)氧化亚铜和稀硫酸反应生成硫酸铜和铜,氧化铜和稀硫酸反应生成硫酸铜;
(3)溶解时要加入氧化剂使铜被氧化,且不能引进新的杂质;
(4)根据pH变化求出氢离子的物质的量变化,根据电解方程式计算转移的电子数;
(5)固体质量减少时,胆矾开始分解,根据减少的质量确定b、c段固体的化学式,从而确定发生的反应,根据最终剩余固体的质量采用假设的方法确定物质的组成.
解答 解:(1)化合物中各元素化合价代数和为0,O元素的化合价为-2价,所以Cu元素的化合价为+1价;Cu2S与O2反应得到Cu,Cu的化合价降低,故S的化合价升高,反应为:Cu2S+O2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+SO2,故答案为:+1;Cu2S+O2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+SO2;
(2)氧化亚铜和稀硫酸反应生成硫酸铜、铜和水,生成红色物质的离子方程式为:Cu2O+2H+=Cu+Cu 2++H2O,
故答案为:Cu2O+2H+=Cu+Cu 2++H2O;
(3)溶解时要加入氧化剂使铜被氧化,且不能引进新的杂质,硝酸具有强氧化性但引进杂质离子,氢氧化钠没有氧化性且能引进杂质离子,双氧水具有强氧化性且不引进杂质离子,故选C;
故答案为:C;
(4)若硫酸铜溶液的体积为0.2L,电解溶液一段时间后溶液的pH由2变为1,则电解生成的氢离子为0.2L×(0.1-0.01)mol/L=0.018mol,
电极方程式为:2H2O-4e-=O2↑+4H+,则n(e-)=n(H+)=0.018mol;
故答案为:0.018mol;
(5)硫酸铜的物质的量=$\frac{5.00g}{250g/mol}$=0.02mol,根据胆矾的化学式知,结晶水的质量=0.02mol×5×18g/mol=1.8g,当固体质量减少1.8g时胆矾完全分解,258℃时,固体减少的质量=5.00g-3.20g=1.80g,所以C段固体是硫酸铜,b段物质减少的质量=5.00g-3.56g=1.44g,则失去的水的物质的量=$\frac{1.44g}{18g/mol}$=0.08mol,则固体中剩下水的物质的量为0.02mol×5-0.08mol=0.02mol,则b段固体的化学式为CuSO4.H2O,该反应方程式为:CuSO4•H2O $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+H2O;
e点时固体质量为1.44g,铜的质量=0.02mol×64g/mol=1.28g,则另一种元素质量为1.44g-1.28g=0.16g,如果另一种元素是S元素,则硫的物质的量为$\frac{0.16g}{32g/mol}$=0.005mol,铜原子的物质的量为0.02mol,则Cu和S的个数比为4:1,不符合化合价原则,所以另一种元素是氧元素,其物质的量为$\frac{0.16g}{16g/mol}$=0.01mol,所以其化学式为Cu2O,
故答案为:CuSO4•H2O $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+H2O;Cu2O.
点评 本题考查了物质的量的有关计算,结合元素化合价变化及氧化还原反应来分析解答,难点是(4)题,根据固体质量变化确定每一段物质的组成,从而确定每一段发生的反应,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 过氧化钙(CaO2)的电子式: | |
| B. | 816O2-离子的结构示意图: | |
| C. | H2CO3的电离方程式:H2CO3?2H++CO32- | |
| D. | 葡萄糖的结构简式:C6H12O6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 干电池原理示意图如图,电池总反应为:Zn+2NH4+=Zn2++2NH3↑+H2↑,下列说法正确的是( )
干电池原理示意图如图,电池总反应为:Zn+2NH4+=Zn2++2NH3↑+H2↑,下列说法正确的是( )| A. | 碳为电池的正极 | |
| B. | Zn极上发生还原反应 | |
| C. | 常见锌锰干电池为二次电池 | |
| D. | 反应2NH4++2e-=2NH3↑+H2↑在负极上发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.06mol•L-1•min-1 | B. | 0.001mol•L-1•s-1 | ||
| C. | 0.04mol•L-1•min-1 | D. | 0.0005mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.071 | 0.099 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -1 |
| A. | A、B简单离子半径大小关系为B3+>A2+ | |
| B. | D、E形成的简单离子的还原性:E->D- | |
| C. | 气态氢化物的稳定性:HD<H2C | |
| D. | 最高价氧化物对应的水化物的酸性:H2CO4>HEO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
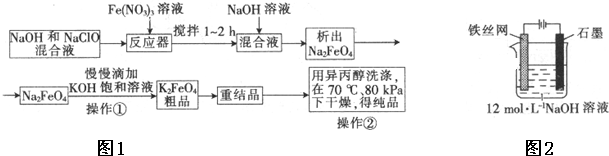
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
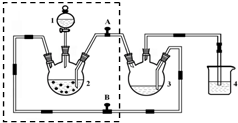 醋酸亚铬水合物([Cr(CH3COO)2)]2•2H2O,深红色晶体)是一种氧气吸收剂,通常以二聚体分子存在,不溶于冷水和醚,微溶于醇,易溶于盐酸.实验室制备醋酸亚铬水合物的装置如图所示,涉及的化学方程式如下:
醋酸亚铬水合物([Cr(CH3COO)2)]2•2H2O,深红色晶体)是一种氧气吸收剂,通常以二聚体分子存在,不溶于冷水和醚,微溶于醇,易溶于盐酸.实验室制备醋酸亚铬水合物的装置如图所示,涉及的化学方程式如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
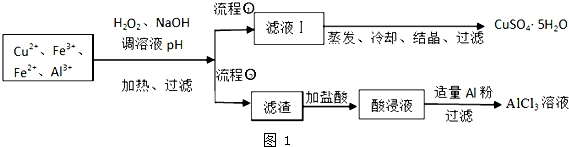
| 离子 | Fe3+ | Fe2+ | Al3+ | Cu2+ |
| pH范围 | 2.2~3.2 | 5.5~9.0 | 4.1~5.0 | 5.3~6.6 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对于元素周期表和元素周期律的发现有突出贡献的科学家是阿伏加德罗 | |
| B. | 元素周期表根据相对原子质量从小到大的顺序排列 | |
| C. | 现常见的元素周期表有七个横行,分为七个周期,有18个纵行,分为16个族 | |
| D. | 每一周期都是从金属元素开始,非金属元素结束 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com