
用NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.78g 苯含有C=C双键的数目为3NA
B.室温下,1LpH=13的Ba(OH)2溶液中,溶液中的OH-离子数目为0.2NA
C.0.1molMg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为0.2NA
D.含2molH2SO4的浓硫酸与足量铜片在加热条件下反应,产生NA个SO2气体分子
科目:高中化学 来源:2015届湖南省高三上学期第三次月考化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定环境下能大量共存的是 ( )
A.pH=7的溶液中Al3+、Cl-、SO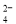 、HCO
、HCO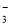
B.由水电离出来的c(H+)=10-12mol/L的溶液中Na+、HCO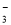 、SO
、SO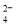 、K+
、K+
C.pH=0的溶液中Na+、K+、Fe2+、ClO-
D.c(OH-)=10-2mol/L的溶液中S2-、SO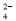 、S2O
、S2O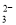 、Na+
、Na+
查看答案和解析>>
科目:高中化学 来源:2015届湖南省益阳市高三上学期第二次模拟考试化学试卷(解析版) 题型:选择题
下列依据相关实验得出的结论正确的是
A.向某溶液中加入稀盐酸,产生的气体能使澄清石灰水变浑浊,该溶液一定是碳酸盐溶液
B.用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液
C.将某气体通入溴水中,溴水颜色褪去,该气体一定是乙烯
D.向某溶液中滴加KSCN 溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含Fe2+
查看答案和解析>>
科目:高中化学 来源:2015届湖南省益阳市高三上学期第三次模拟考试化学试卷(解析版) 题型:选择题
某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol·L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示。则下列说法不正确的是
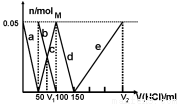
A.M点时生成的CO2为0mol
B.原混合溶液中的CO32-与AlO2-的物质的量之比为1:2
C.V1:V2=1:4
D.a曲线表示的离子方程式为:AlO2-+H+ + H2O=Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源:2015届湖南省益阳市高三上学期第三次模拟考试化学试卷(解析版) 题型:选择题
X、Y、Z、W为周期表中前20号元素中的四种,原子序数依次增大,W、Y为金属元素,X原子的最外层电子数是次外层电子数的3倍,Y、Z位于同周期,Z单质是一种良好的半导体。W能与冷水剧烈反应,Y、Z原子的最外层电子数之和与X、W原子的最外层电子数之和相等。下列说法正确的是
A.原子半径:W>Y>Z>X
B.气态氢化物的稳定性:X<Z
C.最高价氧化物对应水化物的碱性:Y>W
D.Y、Z的氧化物都有酸性和碱性
查看答案和解析>>
科目:高中化学 来源:2015届湖南省高三10月月考化学试卷(解析版) 题型:填空题
(10分)分子筛是一种具有立方晶格的硅铝酸盐化合物。分子筛具有均匀的微孔结构,它的孔穴直径大小均匀,这些孔穴能把比其直径小的分子吸附到孔腔的内部,并对极性分子和不饱和分子具有优先吸附能力,因而能把极性程度不同,饱和程度不同,分子大小不同及沸点不同的分子分离开来,即具有“筛分”分子的作用,故称分子筛。由于分子筛具有吸附能力高,热稳定性强等其它吸附剂所没有的优点,使得分子筛获得广泛的应用。某种型号的分子筛的工业生产流程可简单表示如下:

在加NH3? H2O调节pH的过程中,若pH控制不当会有Al(OH)3生成,假设生产流程中铝元素和硅元素均没有损耗,钠原子的利用率为10℅。
(1)分子筛的孔道直径为 称为4A型分子筛,当Na+被Ca2+取代时就制得5
称为4A型分子筛,当Na+被Ca2+取代时就制得5 型分子筛,当Na+被K+取代时就制得3
型分子筛,当Na+被K+取代时就制得3 型分子筛。要高效分离正丁烷(分子直径为4.65
型分子筛。要高效分离正丁烷(分子直径为4.65 )和异丁烷(分子直径为5.6
)和异丁烷(分子直径为5.6 )应该选用 型分子筛
)应该选用 型分子筛
(2)Al2(SO4)3溶液与Na2SiO3溶液反应生成胶体的离子方程式为 。
(3)该生产流程中所得滤液里含有的离子除H+、OH-外,主要为 。
(4)该生产流程中所得分子筛的化学式为 。
(5)加NH3·H2O调节pH后,加热到900C并趁热过滤的原因可能是 .
查看答案和解析>>
科目:高中化学 来源:2015届湖南省高三10月月考化学试卷(解析版) 题型:选择题
已知A、B、C、D、E是短周期中原子序数依次增大的5种元素,其中A与C可形成化学式为A2C,A2C2的化合物,D的最高价氧化物对应水化物呈强碱性,B与E可形成直线型分子且每个原子最外层都满足8电子稳定结构,则下列说法正确的是
A.原子半径:D>E>B>C>A
B、工业上制取单质D是采用电解D的熔融氧化物
C.D与E形成的化合物溶于水呈弱酸性
D.C与D形成的化合物与D、E形成的化合物,化学键类型一定相同
查看答案和解析>>
科目:高中化学 来源:2015届湖南省名校高三第二次联考化学试卷(解析版) 题型:选择题
汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3 =K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75mol,则下列判断正确的是
A.生成40.0LN2(标准状况) B.有0.250molKNO3被氧化
C.转移电子的物质的量为1.25mol D.被氧化的N原子的物质的量为3.5mol
查看答案和解析>>
科目:高中化学 来源:2015届湖南省高三第二次月考化学试卷(解析版) 题型:选择题
将一定量的NaHCO3和Na2O2混合,在密闭容器中充分混合加热后,最后排出气体,得残留固体40.8 g,残留固体恰好与1 L 1 mol/L的稀盐酸溶液完全反应,下列说法正确的是( )
A.40.8 g固体物质为Na2CO3
B.40.8 g固体物质为NaOH和Na2O2混合物
C.40.8 g固体物质为0.2 mol NaOH和0.4 mol Na2CO3混合物
D.40.8 g固体物质为0.2 mol NaOH、0.2 mol Na2CO3、0.2 mol Na2O2混合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com