
| A. | 铝溶于氢氧化钠溶液:Al+2OH-+H2O═A1O2-+2H2↑ | |
| B. | 用H2O2从酸化的海带灰浸出液中提取碘:2I-+H2O2═I2+2OH- | |
| C. | 将等体积等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| D. | 向苯酚钠溶液中通入少量的CO2:2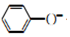 +CO2+H2O→2 +CO2+H2O→2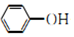 +CO${\;}_{3}^{2-}$ +CO${\;}_{3}^{2-}$ |
分析 A.电荷不守恒;
B.不符合反应客观事实;
C.碳酸氢钠与氢氧化钡等物质的量反应生成碳酸钡、氢氧化钠和水;
D.苯酚钠与少量的二氧化碳反应生成苯酚和碳酸氢钠.
解答 解:A.铝溶于氢氧化钠溶液生成偏铝酸钠和氢气,离子方程式:2Al+2OH-+2H2O═2A1O2-+3H2↑,故A错误;
B.用H2O2从酸化的海带灰浸出液中提取碘,酸性环境下不能生成氢氧根离子,正确的离子方程式:2H++2I-+H2O2═I2+2H2O,故B错误;
C.将等体积等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合,离子方程式:HCO3-+Ba2++OH-═BaCO3↓+H2O,故C正确;
D.向苯酚钠溶液中通入少量的CO2: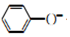 +CO2+H2O→
+CO2+H2O→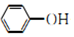 +HCO3-,故D错误;
+HCO3-,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意化学式的拆分,题目难度中等.


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:选择题
| A. | 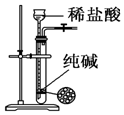 用图装置制取少量CO2气体 | |
| B. | 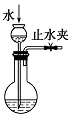 图可检查该装置的气密性 | |
| C. | 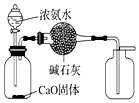 用图装置制取并收集干燥的NH3 | |
| D. | 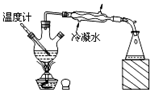 装置可分离沸点不同且互溶的液体混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
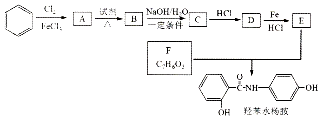
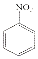 $→_{HCl}^{Fe}$
$→_{HCl}^{Fe}$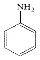
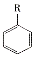 (R-烷基)$\stackrel{KMnO_{4}/H+}{→}$
(R-烷基)$\stackrel{KMnO_{4}/H+}{→}$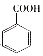
 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$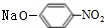 +NaCl+H2O.
+NaCl+H2O. .
.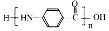 的合成路线
的合成路线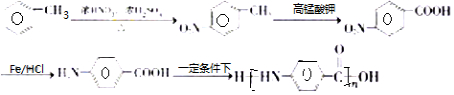 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 生产上用过量烧碱溶液处理某矿物(含Al2O3、MgO),过滤后得到滤液用NaHCO3溶液处理,测得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下:下列有关说法不正确的是( )
生产上用过量烧碱溶液处理某矿物(含Al2O3、MgO),过滤后得到滤液用NaHCO3溶液处理,测得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下:下列有关说法不正确的是( )| A. | NaHCO3溶液的物质的量浓度为0.8 mol/L | |
| B. | b点与c点溶液所含微粒种类相同 | |
| C. | a点溶液中存在的离子是Na+、AlO2-、OH-、H+ | |
| D. | 生成沉淀的离子方程式为:HCO3-+AlO2-+H2O═Al(OH)3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
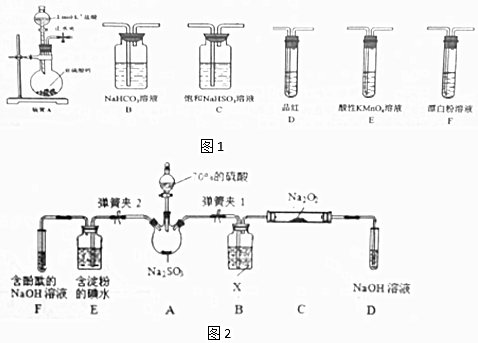
| 操作步骤 | 实验现象 | 解释原因 |
| 关闭弹簧夹2,打开弹簧夹1,注入硫酸至浸没三颈烧瓶中固体 | 若将带火星的木条放在D试管口处,木条不复燃 | SO2与Na2O2反应无O2生成,可能发生的化学反应方程式为①Na2O2+SO2=Na2SO4 |
| 若将带火星的木条放在D试管口处,木条复燃 | SO2与Na2O2反应有O2生成,发生的化学反应为:2SO2+2Na2O2═2Na2SO3+O2 | |
| 关闭弹簧夹1,打开弹簧夹2,残余气体进入E,F中. | E中②E 中溶液蓝色褪去 | E中反应的离子方程式③SO2+I2+2H2O=2I-+SO42-+4H+ |
| F中④F 中红色变浅或褪色 | F中反应为2OH-+SO2═SO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第三周期第ⅤA族 | B. | 第四周期第ⅤA族 | C. | 第五周期第ⅢA族 | D. | 第四周期第ⅢA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标况下,22.4升的H2O含有的水分子数为NA | |
| B. | 标况下,11.2升CCl4中含有的Cl原子数为2NA | |
| C. | 17克NH3中含有的电子总数为10NA | |
| D. | 0.5mol/L的H2SO4溶液中含有的H+数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| HClO | HSCN | H2CO3 |
| K=3.2×10-8 | K=0.13 | K1=4.3×10-7 K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙酸乙酯广泛用于药物、染料、香料等工业,中学化学实验常用装置来制备.
乙酸乙酯广泛用于药物、染料、香料等工业,中学化学实验常用装置来制备.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com