

分析 (1)依据化学反应的方向分析,加入乙醇过量会提高高1-萘酚的转化率;长玻璃管起到冷凝回流的作用,提高乙醇原料的利用率;
(2)提纯产物用10%的NaOH溶液碱洗并分液,把硫酸洗涤去,水洗并分液洗去氢氧化钠,用无水氯化钙干燥并过滤,吸收水,控制沸点通过蒸馏的方法得到;
(3)依据蒸馏装置分析选择仪器;
(4)时间延长、温度升高,1-乙氧基萘的产量下降的原因可能是酚羟基被氧化,乙醇溶解等;
(5)用金属钠检验1-乙氧基萘是否纯净,依据钠和酚羟基反应生成氢气分析判断.
解答 解:(1)将72g1-萘酚溶于100mL无水乙醇中,加入5mL浓硫酸混合,将混合液置于如图1所示的容器中加热充分反应.实验中使用过量乙醇的原因是提高1-萘酚的转化率或作溶剂;乙醇易挥发,烧瓶上连接长直玻璃管的主要作用是冷凝回流,提高原料乙醇的利用率,
故答案为:提高1-萘酚的转化率;冷凝回流,提高原料乙醇的利用率;
(2)提纯产物用10%的NaOH溶液碱洗并分液,把硫酸洗涤去,水洗并分液洗去氢氧化钠,用无水氯化钙干燥并过滤,吸收水,控制沸点通过蒸馏的方法得到,实验的操作顺序为:③②④①;
故答案为:A;
(3)蒸馏装置所用的玻璃仪器除了酒精灯、冷凝管、接收器、锥形瓶外还有温度计、蒸馏烧瓶,
故答案为:温度计、蒸馏烧瓶;
(4)图象分析可知,时间延长、温度升高,1-乙氧基萘的产量下降的原因可能是酚羟基被氧化,乙醇易挥发易溶解,易发生副反应导致产量减小,
故答案为:1-萘酚被氧化;温度高乙醇大量挥发或温度高发生副反应;
(5)用金属钠检验1-乙氧基萘是否纯净,钠和酚羟基反应生成氢气,取少量经提纯的产品于试管A中,加入金属钠若无气泡产生,则产品纯净;若有气泡产生,则产品不纯,
故答案为:加入金属钠有气泡生成则产物不纯,无气泡生成则产物纯净.
点评 本题考查了有机物的性质类推分析判断,官能团的性质应用是解题关键,实验基本操作和物质性质的熟练掌握是解题关键,题目难度中等.


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案科目:高中化学 来源: 题型:选择题
| A. | 分子间作用力无一定方向性 | B. | 占据晶格结点的微粒是原子 | ||
| C. | 化学键是共价键 | D. | 三者都是 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 或
或 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
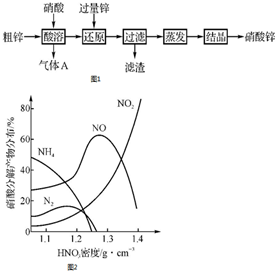 硝酸锌常用于工业电镀、媒染剂等,用粗锌[含少量Zn2(OH)2CO3、Fe和Cu]和硝酸为原料制备硝酸锌的实验流程如图1.活泼金属(如Zn、Fe、Mg等)与不同浓度HNO3溶液反应时主要还原产物不同.如图2是Fe与不同浓度HNO3溶液反应时的主要还原产物.
硝酸锌常用于工业电镀、媒染剂等,用粗锌[含少量Zn2(OH)2CO3、Fe和Cu]和硝酸为原料制备硝酸锌的实验流程如图1.活泼金属(如Zn、Fe、Mg等)与不同浓度HNO3溶液反应时主要还原产物不同.如图2是Fe与不同浓度HNO3溶液反应时的主要还原产物.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 得到碘酸钾晶体,你建议的方法是蒸发结晶.
得到碘酸钾晶体,你建议的方法是蒸发结晶.| 温度/℃ | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3 g/100g水 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 +2H2O;
+2H2O; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量金属钠保存在煤油中 | |
| B. | FeSO4溶液存放在加有少量铁粉的试剂瓶中 | |
| C. | 氢氧化钠溶液保存在配有玻璃塞的细口瓶中 | |
| D. | 氢氟酸保存在塑料试剂瓶中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com