
下列物质的化学式,错误的是
| A.重晶石 BaCO3 | B.明矾 KAl(SO4)2·12H2O |
| C.石膏 CaSO4·2H2O | D.绿矾 FeSO4·7H2O |
科目:高中化学 来源: 题型:




查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)为测定氯化钾和硫酸钾混合物中氯化钾的含量,某同学设计了如下实验:称量样品,溶解,添加适量A溶液,过滤,得沉淀和滤液B,将沉淀洗涤,烘干,得物质C。
回答下列问题:
(1)溶液A溶质的化学式_____,物质C的化学式____。
(2)用托盘天平称量样品,当天平平衡时,发现左盘错放砝码质量为26g,游码为0.4g,则右盘样品实际质量是____。
(3)若过滤使用的仪器和用品已有:滤纸、铁架台、铁圈、烧杯、漏斗,还需要补充的仪器或用品是______。
(4)若C的质量为23.3g,则原混合物中氯化钾的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
《物质结构与性质》
19-1.(6分,该题为多项选择题,全选对得6分,漏选按比例给分,错选或多选为0分)下列说法正确的是 ( )
A.基态原子中不一定都有未成对的电子
B.由极性键形成的分子一定是极性分子
C.晶格能大小顺序:NaCl > KCl
D.离子晶体中每个阳离子周围均吸引着6个带相反电荷的离子
E.在CaO和SiO2晶体中,都不存在单个小分子
19-2.(14分)四种常见元素的性质或结构信息如下表,试根据信息回答有关问题。
| 元素 | A | B | C | D |
| 性质 结构 信息 | 基态原子核外有两个电子层,最外层有3个未成对的电子 | 基态原子的M层有1对成对的p电子 | 基态原子核外电子排布为[Ar]3d104sx,有+1、+2两种常见化合价 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
(1)写出B原子的基态电子排布式 。
(2)A元素的氢化物的沸点比同主族相邻元素氢化物沸点 (填“高”或“低”),其原因是 。
(3)D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点 (填“高”或“低”),其原因是 。
(4)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为 ,简要描述该配合物中化学键的成键情况 。
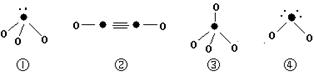
(5)下列分子结构图中的“●”表示上述相关元素的原子中除去最外层电子的剩余部分,“ O”表示氢原子,小黑点“ ·”表示没有形成共价键的最外层电子,短线表示共价键。
则在以上分子中,中心原子采用sp3杂化形成化学键的是 (填写序号);在②的分子中有 个σ键和 个π键。
查看答案和解析>>
科目:高中化学 来源:2010年海南省高三五校联考化学试题 题型:填空题
《物质结构与性质》
19-1.(6分,该题为多项选择题,全选对得6分,漏选按比例给分,错选或多选为0分)下列说法正确的是 ( )
| A.基态原子中不一定都有未成对的电子 |
| B.由极性键形成的分子一定是极性分子 |
| C.晶格能大小顺序:NaCl > KCl |
| D.离子晶体中每个阳离子周围均吸引着6个带相反电荷的离子 |
| 元素 | A | B | C | D |
| 性质 结构 信息 | 基态原子核外有两个电子层,最外层有3个未成对的电子 | 基态原子的M层有1对成对的p电子 | 基态原子核外电子排布为[Ar]3d104sx,有+1、+2两种常见化合价 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
查看答案和解析>>
科目:高中化学 来源:2011届山东省临沂市高三上学期期中考试化学试题 题型:实验题
垃圾是放错地方的资源,工业废料也可以再利用。某化学兴趣小组在实验室中用废弃含有铝、铁、铜的合金制取硫酸铝溶液、硝酸铜晶体和铁红(Fe2O3)。其实验方案如下: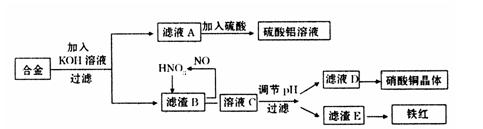
(1)请写出在合金中加入KOH溶液后所发生的离子反应方程式:
。
(2)在滤液A中直接加入硫酸所获得的硫酸铝溶液中会含有杂质(K2SO4),请设计一个更合理的实验方案由滤液A制备纯净的硫酸铝溶液。仿照上图形式画出制备流程图:(提示:在箭头上下方标出所用试剂或实验操作)
(3)已知Fe(OH)3沉淀的pH是2~3.2。溶液C通过调节pH可以使Fe3+沉淀完全。下列物
质中,可用作调整溶液C的pH的试剂是 (填序号)
| A.铜粉 | B.氨水 | C.氧化铜 | D.氢氧化铜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com