
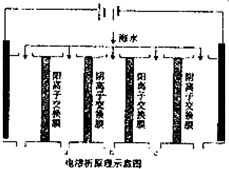
 水是一种重要的自然资源,是人类赖以生存不可缺少的物质.水的处理主要包括水的净化、污水处理、硬水软化和海水的淡化等.
水是一种重要的自然资源,是人类赖以生存不可缺少的物质.水的处理主要包括水的净化、污水处理、硬水软化和海水的淡化等. ,请写出ABS的结构简式
,请写出ABS的结构简式| 6.8×104g |
| 80g/mol |
| ||
| ||
 ,则反应生成的高分子化合物为:
,则反应生成的高分子化合物为: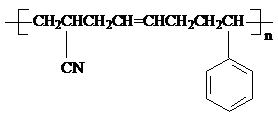 .
.


科目:高中化学 来源: 题型:
| A、都由C和H两种元素组成 |
| B、都能使酸性KMnO4溶液褪色 |
| C、都能发生加成反应和取代反应 |
| D、在氧气中完全燃烧后都生成CO2和H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
 +N2↑+3CO2↑
+N2↑+3CO2↑查看答案和解析>>
科目:高中化学 来源: 题型:
 能量是一个世界性的话题,如何充分利用能量、开发新能源,为人类服务是广大科技工作者不懈努力的目标.
能量是一个世界性的话题,如何充分利用能量、开发新能源,为人类服务是广大科技工作者不懈努力的目标.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com