
【题目】把一块镁铝合金投入到过量的1 mol·L-1盐酸中,待合金完全溶解后,再往溶液里加入1 mol·L-1NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如图所示,下列说法中错误的是( )
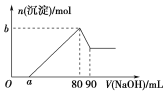
A. 盐酸的体积为90 mL
B. a的取值范围为0<a<50
C. n(Mg2+)<0.025 mol
D. 当a值为30时,b值为0.02
【答案】A
【解析】
第一阶段,盐酸和氢氧化钠反应:H++OH-=H2O;第二阶段,氯化镁、氯化铝和氢氧化钠反应Mg2++2OH-=Mg(OH)2↓,Al3++3OH-=Al(OH)3↓,第三阶段,氢氧化铝溶解:Al(OH)3+NaOH=NaAlO2+2H2O,第四阶段无反应,沉淀全为Mg(OH)2,据此解答。
A、第一阶段,盐酸和氢氧化钠反应:H++OH-=H2O;第二阶段,氯化镁、氯化铝和氢氧化钠反应Mg2++2OH-=Mg(OH)2↓,Al3++3OH-=Al(OH)3↓,在V(NaOH)=80mL时沉淀达到最大值,溶液中溶质全为NaCl,根据原子守恒可知n(HCl)=n(NaCl)=n(NaOH)=0.08mol,所以盐酸的体积为80mL,A错误;
B、第三阶段,氢氧化铝溶解:Al(OH)3+NaOH=NaAlO2+2H2O,因为此时消耗NaOH溶液体积10mL,所以第二阶段和Al3+反应的NaOH为30mL,假设无Mg2+,a=50,而实际存在Mg2+,所以0<a<50,B正确;
C、第三阶段,氢氧化铝溶解:Al(OH)3 +NaOH=NaAlO2+2H2O,因为此时消耗NaOH溶液体积为10mL,所以n(Al3+)=0.01mol,第四阶段无反应,沉淀全为Mg(OH)2,若a=0,n(Mg2+)取得最大值,第二阶段和Al3+反应的NaOH为30mL,所以此时和Mg2+反应的NaOH为50mL,所以镁离子物质的量的最大值是0.025mol,由于a>0,所以n(Mg2+)<0.025mol,C正确;
D、a=30时,和Mg2+反应的NaOH为20mL,此时n(Mg2+)=0.01mol,b=n(Mg2+)+n(Al3+)=0.02mol,D正确。
答案选A。


科目:高中化学 来源: 题型:
【题目】元素周期表中,除了22种非金属元素外,其余的都是金属,请根据元素周期表回答下列问题:
I.(1)基态氮原子核外共有_______种运动状态不相同的电子,该原子核外电子排布中电子在能量最低的轨道呈_______形,用n表示能层,氟元素所在族的外围电子排布式为______________。
(2)在元素周期表中,某些主族元素与下方的主族元素的性质有些相似,被称为“对角线规则”,如下表:

根据“对角线规则”写出Be(OH)2与NaOH反应的离子方程式______________,硼酸(H3BO3)是一种具有片层结构的白色晶体,层内的H3BO3分子间通过氢键相连(如图)。含1mol H3BO3的晶体中有__________mol氢键,H3BO3中B原子的杂化类型为_____________。

(3)以第二周期为例,除Be、N外,其它元素的第一电离能从左到右逐渐增大的原因是____________________________________________________。
II.近年来铁及其化合物在工农业中有广阔的应用前景。
(4)铁的一种络离子[Fe(CN)6]4-中Fe2+的配位数为6,该络离子中不存在______(填序号)。
A.共价键 B.非极性键 C.配位键 D.δ键 E.π键
(5)AlCl3的熔点比NaCl熔点低的原因是____________________________________。
(6)一种Al-Fe合金的立体晶胞如图所示。若晶体的密度为ρ gcm-3,则此合金中最近的两个Fe原子之间的距离为__________cm(用含ρ的代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水的电离方程式:H2O![]() H++OH-。下列叙述中,正确的是
H++OH-。下列叙述中,正确的是
A. 升高温度,Kw增大,pH不变
B. 向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低
C. 向水中加入少量硫酸,c(H+)增大,Kw不变
D. 向水中加入少量固体CH3COONa,平衡向逆反应方向移动,c(H+)降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用氯化铜晶体(CuCl2·2H2O,含氯化亚铁杂质)制取纯净的CuCl2·2H2O。先将其制成水溶液,后按如图步骤进行提纯:

已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见下表
金属离子 | Fe3+ | Fe2+ | Cu2+ |
氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
氢氧化物沉淀完全时的pH | 3.2 | 9.0 | 6.7 |
请回答下列问题:
(1)现有氧化剂NaClO、H2O2、KMnO4,X加哪种好,为什么?________________________________,该反应的离子方程式为_________________________________。
(2)溶液II中除Cu2+外,还有______金属离子,检验试剂为______________。物质Y不能为下列的________________________。
a.CuO b.Cu(OH)2 c.CuCO3 d.Cu2(OH)2CO3 e.CaO f.NaOH
(3)常温下,除去CuCl2溶液中的Fe2+,加入氧化剂X,使Fe2+氧化为Fe3+,然后加入物质Y至溶液pH=4,此时c(Fe3+)=_________mol/L,[已知Fe(OH)3的Ksp=4×10-38]
(4)若在空气中加热固体CuCl2·2H2O,可水解生成Cu(OH)Cl,写出相关的化学方程式_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】软锰矿的主要成分是MnO2,其悬浊液可吸收烟气中SO2,所得酸性浸出液又可用于制备高纯硫酸锰,其一种工艺流程如图所示。回答下列问题:

(1)软锰矿悬浊液吸收SO2的过程中,SO2体现了________性。
(2)“氧化剂”发生反应的离子方程式为____________。
(3)已知:Ksp[Al(OH) 3]=1.0×10-34;
Krp[Fe(OH) 3]=2.6×10-30;
Krp[Ni(OH) 2]=1.6×10-15;
Krp[Mn(OH) 2]=4.0×10-14;
“水解沉淀“中:
①“中和剂“可以是________(填标号)
A.Al2O3 B.H2SO4 C.MgO D.MnO2
②溶液的pH应不低于________(离子浓度小于1×10-5mol·L-1时,即可认为该离子沉淀完全)
③不采用“水解沉淀“除Ni2+的原因是___________。
(4)“置换”中发生反应的离子方程式为____________。
(5)“结品分离”中的部分物质的溶解度曲线如图。

①加入稀硫酸的作用是(结合平衡移动原理解释)_____________。
②结晶与过滤过程中,体系温度均应维持在_______℃(填“27”、“60”或“70”)。
(6)高纯硫酸锰可用于水中溶解氧含量的测定,步骤如下:
步骤1:水中的氧气在碱性溶液中将MnSO4氧化为MnO(OH)2。
步骤2:在酸性条件下,加入KI将生成的MnO(OH)2再还原成Mn2+。
步骤3:用Na2S2O3标准溶液滴定步骤2中生成的I2(2S2O32-+I2=2I-+S4O62-)。
取某水样100mL,按上述测定步骤滴定,消耗a mol·L-1 NaS2O3标准溶液VmL,该水样溶解氧含量为
_________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】霞石是一种硅酸盐,其组成可表示为K2O·3Na2O·4Al2O3·8SiO2,某小组同学设计以霞石为原料制备Al2O3的方案如下:

请回答下列问题:
(1)沉淀1的化学式为______________________________________________。
(2)滤液1与过量NaOH溶液反应的所有的离子方程式为____________。
(3)写出由溶液2生成Al(OH)3的离子方程式:_______________________。
(4)通入过量的CO2,过滤后的滤液中含有的阴离子主要是________。
(5)由Al(OH)3→Al2O3的反应条件为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2011年,麻省理工学院科研团队研发出一种人造树叶,它将一片半导体材料夹在两层特殊的催化剂的中间。若将人造树叶整体浸泡在溶液中,当光照在人造树叶上,就会分解水生成H2和O2,结构如图所示。下列有关人造树叶说法正确的是

A. 该装置最终将太阳能转变为电能
B. Ni、Mo、Zn基催化剂极为阳极,发生氧化反应
C. 可以将人造树叶浸泡在碱性溶液中
D. 钴基催化剂上发生反应:2H2O-4e-=4H++O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 氯化铵溶液,加水稀释时,c(NH4+)/c(Cl-)的值一定减小
B. 0.1 mol·L-1的盐酸和0.1 mol·L-1的弱酸HA溶液分别加水稀释10倍:pH(HA) > pH(盐酸)
C. 已知25℃时,HA的Ka=6.25×10—5,当pH为5.0时,HA溶液中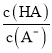 = 0.16
= 0.16
D. 某二元酸的酸式盐NaHA溶液中必然存在:c(H+)+c(A2—)=c(OH—)+c(H2A)
【答案】D
【解析】A、加水稀释时,促进铵根离子水解,所以铵根离子浓度减小的程度大,c(NH4+)/c(Cl-)的值一定减小,选项A正确;B、0.1 mol·L-1的盐酸(pH=1)和0.1 mol·L-1的弱酸HA(pH>1)溶液分别加水稀释10倍后,盐酸的pH=2,HA的pH>2,pH(HA) > pH(盐酸),选项B正确;C、根据HA![]() H++A-,Ka=
H++A-,Ka=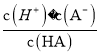 =6.25×10-5,故当溶液的pH为5.0时,c(H+)=10-5 mol·L-1,HA溶液中
=6.25×10-5,故当溶液的pH为5.0时,c(H+)=10-5 mol·L-1,HA溶液中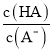 =
=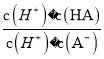 =
=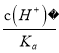 =
=![]() =0.16,选项C正确;D、依据溶液中电荷守恒和物料守恒计算分析,某二元弱酸的酸式盐NaHA溶液中电荷守恒c(H+)+c(Na+)=c(OH-)+c(HA-)+2c(A2-),物料守恒c(Na+)=c(H2A)+c(HA-)+c(A2-),计算得到c(OH-)+c(A2-)=c(H+)+c(H2A),选项D错误。答案选D。
=0.16,选项C正确;D、依据溶液中电荷守恒和物料守恒计算分析,某二元弱酸的酸式盐NaHA溶液中电荷守恒c(H+)+c(Na+)=c(OH-)+c(HA-)+2c(A2-),物料守恒c(Na+)=c(H2A)+c(HA-)+c(A2-),计算得到c(OH-)+c(A2-)=c(H+)+c(H2A),选项D错误。答案选D。
【题型】单选题
【结束】
24
【题目】有关锌-稀硫酸-铜构成的原电池的一些说法中,正确的是( )
A. 锌片为正极,且锌片逐渐溶解
B. 铜片为负极,且铜片上有气泡
C. 溶液中的H+移向铜极
D. 该电池工作的过程中溶液的酸性始终不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com