
【题目】根据下列三个反应,判断物质的氧化性由强到弱的顺序正确的是( )
①2Fe3++2I-===2Fe2++I2
②2Fe2++Cl2===2Fe3++2Cl-
③2MnO![]() +10Cl-+16H+===2Mn2++5Cl2↑+8H2O
+10Cl-+16H+===2Mn2++5Cl2↑+8H2O
A. Fe3+>Cl2>MnO![]() B. Fe3+>Cl2>I2 C. I2>Cl2>Fe3+ D. MnO
B. Fe3+>Cl2>I2 C. I2>Cl2>Fe3+ D. MnO![]() >Cl2>Fe3+
>Cl2>Fe3+
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】I.有四种化合物W、X、Y、Z,它们是由短周期元素A、B、C、D、E中的两种元素组成。已知
(1)A、B、C、D、E的原子序数依次增大,且A、D同主族,C、E同主族;B、C 同周期;
(2)W由A、B组成,其分子中原子个数比为A:B=4:1,常温为气态。
(3)X由A、C组成,其分子中原子数比为A:C=1:1
(4)Y是C、D形成的离子化合物,且Y晶体中相应元素的原子个数比为1:1
(5)Z是由D、E形成的离子化合物,其中阳离子比阴离子少一个电子层,阳离子数与阴离子数之比为2:1 则B为__________,W为_________,X的结构式________Y的电子式为______________。
II.(1).一元素原子的N层上只有1个电子,该元素原子各内层均已充满,写出该原子电子排布式:________________,
(2)一元素属于短周期元素,该元素的原子核外所有P轨道全满或者半满,写出该元素原子的价电子轨道排布图__________________,
(3)乙烯分子中有__________个σ键,___________π键。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门以实验为基础的学科,下列操作或发生事故时的处理方法正确的是
A. 可用燃着的酒精灯引燃另一只酒精灯。
B. 给试管里的液体加热时,试管应与桌面垂直。
C. 配置一定浓度的NaCl溶液时,定容振荡摇匀后,发现液面低于刻度线,再加水到刻度线。
D. 浓硫酸不慎沾在皮肤上,应立即用大量水冲洗,最后涂上3%-5%的小苏打溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年5月18日,中国国土资源部地质调查局宣布,我国在南海进行的可燃冰试采获得成功,成为全球第一个海域试采可燃冰成功的国家,可燃冰即天然气水合物,甲烷含量占80%至99.9%。化工生产中用甲烷和水蒸气反应得到以CO和H2为主的混合气体,这种混合气体可用于生产甲醇或合成氨,回答下列问题:
(1)甲醇是一种用途广泛的化工原料,工业上常用下列两种反应制备甲醇:
CO(g)+2H2(g)=CH3OH(g) △H1 =-90kJ·mol-1 K1
CO2(g)+3H2(g)= CH3OH(g)+H2O(l) △H2 K2
己知: CO(g)+H2O(g)= CO2(g)+H2(g) △H3 =-41.1kJ·mol-1 K3
H2O(l)=H2O(g) △H4 =+44.0kJ·mol-1 K4
则K2=_______ (用含K1、K3、K4的代数式表示)
(2)在一恒温恒容密闭容器中充入1molCO2和3molH2模拟工业合成甲醇的反应:CO2(g)十3H2(g) ![]() CH3OH(g)十H2O(g)
CH3OH(g)十H2O(g)
①下列能说明该反应已达到平衡状态的是______________________。
A.混合气体平均相对分子质量不变 B.混合气体密度不变
C.容器内压强恒定不变 D.反应速率满足以下关系:V正(CO2)=3V逆(H2)
E.CO2、H2、CH3OH、H2O物质的量浓度之比为1:3:1:1
F.单位时间内断裂3NAH-H键的同时形成2molH-O键
②模拟过程中测得CO2和CH3OH(g)浓度随时间变化如图所示,若此时容器内压强为P,则用平衡分压代替平衡浓度表示的化学平衡常数KP为_____________(用含P的代数式表示,数值保留两位小数),若此时再向容器内充入0.25molCO2和0.25molCH3OH的混合气体,则平衡______(填“正向“逆向“不”)移动。(已知:气体分压=气体总压×体积分数)
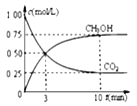
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“化学是你,化学是我”.化学与生产、生活密切相关,下列说法错误的是( )
A. 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈
B. 水泥冶金厂常用高压电除去工厂烟尘,利用了胶体的性质
C. 开发利用太阳能、风能、生物能、海洋能等清洁能源,符合“低碳经济”
D. 二氧化硫有漂白性,常用于棉、麻、纸张和食品的漂白
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下列各图所示是中学化学中常用于混合物分离和提纯的装置:
A. 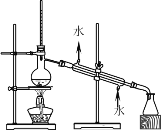 B.
B. 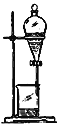
C.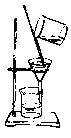 D.
D. 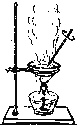
请根据装置图回答下列问题:
⑴A图中用于盛放液体混合物的仪器的名称为:__________________
⑵选择合适的实验装置分离以下混合物(填代表装置的字母),
①从碘水中分离出I2 : ___________
②进行酒精和水的分离: ___________
③二氧化锰和蔗糖溶液: ___________
⑶我国具有历史悠久的酒文化,请回答下列问题:
①要提高酒精的度数,可采用的方法是________________(填操作方法,下同)
②中药常常浸泡在美酒中制成药酒,你认为利用的方法是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数的值为NA。下列说法正确的是
A. 标准状况下,22.4L氨气溶于足量水后含有NA个分子
B. lmol/L的NaClO溶液中含有CIO-的数目小于NA
C. 60gSiO2中含有4molSi-O键
D. lmolN2和4molH2充分反应生成NH3时转移电子总数是6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室要配制480mL 0.2mol·L-1的NaOH溶液:请结合实验回答下列问题:
(1)实验中需称量NaOH固体的质量为__________
(2)实验步骤主要有计算、称量、溶解、转移和定容。
①完成上述实验步骤要用到的玻璃仪器有烧杯、量筒、玻璃棒、__________。
②溶解和转移过程中玻璃棒的作用分别是__________和__________。
(3)分析下列操作对所配制溶液浓度的影响(填 “偏高”“偏低”或“无影响”)。
①转移液体过程中有少量液体溅出:__________;
②定容时仰视刻度线:__________;
③容量瓶洗净后,未经干燥处理:__________;
④将NaOH固体溶解后,直接转至容量瓶中进行实验:__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com