
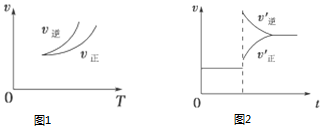
| A. | 图1说明正反应为吸热反应 | |
| B. | 反应达平衡后,增大压强气体密度将减小 | |
| C. | 图2可表示升高温度使平衡向逆反应方向移动 | |
| D. | 图2虚线可表示使用催化剂后引发的反应速率变化 |
分析 A、依据图象分析,温度升高逆反应速率大于正反应速率,平衡逆向进行,逆向是吸热反应;
B、如果体积可变,增大压强,气体体积缩小,密度变大;如果体积不变,增大压强,气体的质量不变,密度不变;
C、若正反应的△H<0,是放热反应升温平衡逆向进行,逆反应速率大于正反应速率;
D、使用催化剂同等程度的改变正逆反应的速率.
解答 解:A、依据图象分析,温度升高逆反应速率大于正反应速率,平衡逆向进行,逆向是吸热反应,正向是放热反应,可以判断反应热量变化,故A错误;
B、如果体积可变,增大压强,气体体积缩小,密度变大;如果体积不变,增大压强,气体的质量不变,密度不变,故B错误;
C、若正反应的△H<0,是放热反应升温平衡逆向进行,逆反应速率大于正反应速率,图象符合反应速率的变化,故C正确;
D、使用催化剂同等程度的改变正逆反应的速率,所以正、逆反应速率增加的幅度相等,故D错误;
故选C.
点评 本题考查化学平衡的建立和影响因素的分析判断,图象分析判断是解题关键,题目难度中等.


科目:高中化学 来源: 题型:实验题

| Ca2+ | Mg2+ | Fe3+ | |
| 开始沉淀的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀的pH | 13.9 | 11.1 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
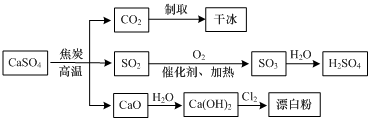
| A. | CO2制取干冰的过程吸收热量,属于物理变化 | |
| B. | 硫酸钙与焦炭反应时生成的n(CO2):n(SO2)=1:2 | |
| C. | 由SO2制取H2SO4的过程均为氧化还原反应 | |
| D. | 石灰乳与Cl2反应制取漂白粉时,Cl2仅作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.1NA | |
| B. | 标准状况下,2.24L乙烷含有的化学键总数为0.8NA | |
| C. | 常温下,23gNO2和N2O4的混合气体中含有的氮原子数为0.5 NA | |
| D. | 标准状况下,22.4L甲醇中含有的氧原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
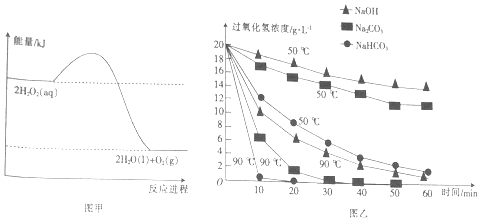
| A. | H2O2的分解反应为放热反应 | |
| B. | 断裂共价键所需的能量:2×E(O-O)<1×E(O=O) | |
| C. | 加入相同物质时,温度越高,H2O2分解的速率越快 | |
| D. | 相同温度下,加入不同物质的溶液,碱性越强,H2O2分解的速率越快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯在空气中燃烧时有黑烟,因此可以用燃烧法区别甲烷和乙烯 | |
| B. | 苯与浓硝酸在浓硫酸存在条件下加热发生取代反应 | |
| C. | 蛋白质溶液中加入饱和硫酸铵溶液,蛋白质发生变性 | |
| D. | 氨基酸能够以不同数目和顺序相结合形成结构复杂的多肽 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
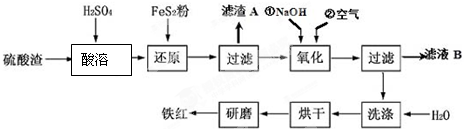
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 |
| 开始沉淀Ph | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
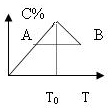 对于反应2A+B?2C的反应过程中C的百分含量随温度的变化如图所示,则:
对于反应2A+B?2C的反应过程中C的百分含量随温度的变化如图所示,则:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com