
分析 根据n=$\frac{V}{{V}_{m}}$计算出标准状况下4.48L氨气的物质的量,然后根据m=nM计算出氨气的质量;氨气分子中含有3个H原子,根据氨气的物质的量计算出含有H原子的物质的量;最后根据c=$\frac{n}{V}$计算出所得溶液的物质的量浓度.
解答 解:标准状况下4.48L的NH3的物质的量为:$\frac{4.48L}{22.4L/mol}$=0.2 mol,质量为:m=nM=0.2 mol×17 g/mol=3.4 g;0.2mol氨气分子中含有H原子的物质的量为:0.2mol×3=0.6mol,含有氢原子数为0.6NA,
将0.2mol氨气溶于水配成200mL溶液,所得溶液的物质的量浓度为:c=$\frac{n}{V}$=$\frac{0.2mol}{0.2L}$=1 mol/L.
故答案为:0.2;3.4;0.6NA;1.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与摩尔质量、物质的量浓度、阿伏伽德罗常数之间的关系为解答关键,试题有利于提高学生的化学计算能力.


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 2CO (g )+O2(g )═2CO2(g );△H=-556kJ•mol-1 | |
| B. | CH4(g )+2O2 (g )═CO2(g )+2H2O (l );△H=-890kJ•mol-1 | |
| C. | 2H2(g )+O2(g )═2H2O(l );△H=-571.6kJ•mol-1 | |
| D. | 2H2(g )+2 Cl2 (g )═4HCl (g);△H=-369.2kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
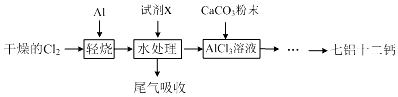
| 开始沉淀的pH | 完全沉淀的pH | |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.5 | 4.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2和O2的反应 | B. | Na和O2的反应 | C. | Fe和Cl2的反应 | D. | 铜和硝酸的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | QGZYX | B. | GYQZX | C. | GYZQX | D. | ZXGYQ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 江河入海口容易形成三角洲 | |
| B. | 当日光从窗隙射入暗室时,可观察到一束光线 | |
| C. | 向氢氧化铁与水形成的某分散系中插入正、负电极,通直流电一段时间后,一极附近颜色变深 | |
| D. | 向氯化铁溶液中加入氢氧化钠溶液,产生红褐色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 外观澄清 | B. | 丁达尔效应 | ||
| C. | 胶体在一定条件下能稳定存在 | D. | 分散质粒子直径在1nm~100nm之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解法精炼铜是,以粗铜作阴极,精铜作阳极 | |
| B. | 加热0.1mol/L的Na2CO3溶液,CO32-的水解程度和溶液的pH均增大 | |
| C. | 1L 1mol/L的NaClO溶液中含有ClO-的数目为6.02×1023 | |
| D. | 相同条件下,溶液中Fe2+、Cu2+、Zn2+的氧化性依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com