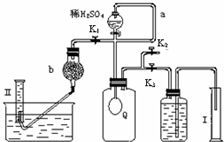
过碳酸钠(Na
2CO
4)在洗涤、印染、造纸、医药卫生等领域有大量应用.
已知:过碳酸钠与硫酸溶液反应的化学方程式如下:
Na
2CO
4+H
2SO
4→Na
2SO
4+H
2O
2+CO
2↑ 2H
2O
2→2H
2O+O
2↑为测定已变质的过碳酸钠(含碳酸钠)的纯度,设计如图所示的实验:Q为-具有良好的弹性的气球(不与反应物和生成物反应),称取一定量的样品和少量二氧化锰放于其中,按图安装好实验装置,打开分液漏斗的活塞,将稀H
2SO
4滴入气球中.
(1)Q内发生反应生成的气体为
CO2、O2
CO2、O2
.导管a作用是
平衡分液漏斗上、下的压强,使稀H2SO4顺利滴下
平衡分液漏斗上、下的压强,使稀H2SO4顺利滴下
.
(2)为测出反应时生成气体的总体积,滴稀H
2SO
4前必须关闭K
1、K
2,打开K
3.当上述反应停止,将K
1、K
2、K
3处于关闭状态,然后先打开K
2,再缓缓打开K
1,这时可观察到的现象是
气球Q慢慢缩小,左侧导管有气泡生成
气球Q慢慢缩小,左侧导管有气泡生成
,b中装的碱石灰的作用是
吸收二氧化碳
吸收二氧化碳
.
(3)实验结束时,量筒I中有xmL水,量筒Ⅱ中收集到ymL气体(上述体积均已折算到标准状况),则过碳酸钠的纯度是
(式量:Na
2CO
4-122,Na
2CO
3-106).
(4)某同学实验测得的过碳酸钠的纯度超过100%,你认为可能的原因是
BC
BC
A.气体滞留在Q和导气管中,未全部进入量筒Ⅱ
B.量筒Ⅱ读数时,量筒液面高于水槽液面
C.右侧量筒Ⅰ和储液集气瓶连接导管内的液体没有计入读数x
D.气体体积数值x、y没有扣除滴加的硫酸的体积.

 过碳酸钠(Na2CO4)在洗涤、印染、造纸、医药卫生等领域有大量应用.
过碳酸钠(Na2CO4)在洗涤、印染、造纸、医药卫生等领域有大量应用.

 名校课堂系列答案
名校课堂系列答案