
【题目】(1)有一种金属单质A,焰色反应颜色呈黄色,能发生如图所示变化:

上图中淡黄色固体B是_____________(填化学式)
(2)二氧化氮(NO2)是一种红棕色的有毒气体,二氧化氮与水反应生成硝酸和___。
(3)写出(1)中C溶液与硝酸反应的化学方程式:________________。
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
【题目】在常温下,0.1000mol/L Na2CO3溶液25mL用0.1000mol/L盐酸滴定,滴定曲线如图.对滴定过程中所得溶液中相关离子浓度间的关系,下列说法正确的是
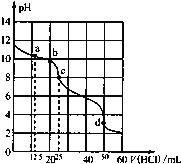
A.a点:c(CO32-)>c(HCO3﹣)>c(OH﹣)
B.b点:5c(Cl-)>4c(HCO3-)+4c(CO32-)
C.c点:c(OH-)=c(H+)+c(HCO3﹣)+2c(H2CO3)
D.d点:c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种电解法合成氨的装置如图所示,该法采用高质子导电性的 SCY 陶瓷,用吸附在它内外表面上的金属 Pd 多晶薄膜做电极,实现了 570℃、常压下高转化率合成氨。下列叙述正确的是
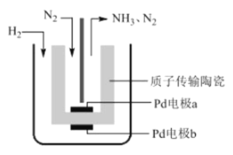
A.阴极的电极反应式为 N2 +8H+ +6e-=2NH4+
B.该装置工作时,H+ 从 a 极区向 b 极区迁移
C.每生成 1mol NH3 ,有 3g H2 被氧化
D.该装置实现了在常温常压下高转化率合成氨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某化工厂以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分Na2Cr2O7.2H2O),其主要工艺流程如下图:
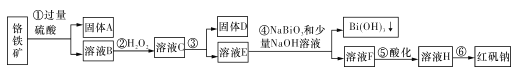
查阅资料得知:
i.常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO42-。
ii.
金属离子 | Fe3+ | Al3+ | Cr3+ | Fe2+ | Bi3+ |
开始沉淀的 pH | 2.7 | 3.4 | 5.0 | 7.5 | 0.7 |
沉淀完全的pH | 3.7 | 4.9 | 5.9 | 9.7 | 4.5 |
回答下列问题:
(1)固体A的主要成分为____(填化学式)。
(2)步骤③加的试剂为氢氧化钠溶液,此时溶液pH要调到5.0的目的是____。
(3)写出④反应的离子反应方程式:____。
(4)取一定质量的固体D溶解于200 mL的硫酸中,向所得溶液中加入5 mol/L的NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V关系如图所示,则加入NaOH溶液体积为200~240 mL时发生反应的化学方程式为____,固体D中含铁化合物的物质的量为____

Ⅱ.经检测该化工厂的工业废水中含5.00×10-3mol/L的Cr2O72-,其毒性较大。该化工厂的科研人员为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4 (Fe的化合价依次为+3、+2),又设计了如下工艺流程:
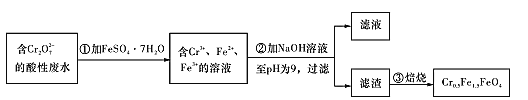
(5)第①步反应的离子方程式为____。
(6)欲使1 L该废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4。理论上需要加FeSO4.7H2O的质量为 ___g(已知FeSO4.7H2O的摩尔质量为278 g/mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是( )
A.18g重水(D2O)所含电子的数目为10NA
B.6.4gS2、S4、S6的混合物中所含硫原子的数目为0.2NA
C.标准状况下,2.24LHF中分子的数目为0.1NA
D.60g乙酸与足量乙醇发生酯化反应时断裂C—O键的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知: 25℃、101 kPa时,
I.H2(g) + ![]() O2(g) = H2O(g) △H1 =- 241.8kJ/mol
O2(g) = H2O(g) △H1 =- 241.8kJ/mol
II.H2(g) + ![]() O2(g) = H2O(l) △H2 =-2858kJ/mol
O2(g) = H2O(l) △H2 =-2858kJ/mol
试回答下列问题:
①能表示氢气燃烧热的热化学方程式为____ (填“I” 或“II”)
②H2O(g) = H2O(l) △H = ___ kJ/mol。
(2)已知: 25℃、101 kPa时,CO(g) + H2O(g)![]() CO2(g) + H2(g) △H = -41.0 kJ/mol。将1molCO和Imol H2O(g)置于1L的密闭容器中,在一定条件下反应达到平衡。试回答下列问题:
CO2(g) + H2(g) △H = -41.0 kJ/mol。将1molCO和Imol H2O(g)置于1L的密闭容器中,在一定条件下反应达到平衡。试回答下列问题:
①放出的热量___41.0kJ(填“>”、“<”或“=”);
②该反应的平衡常数表达式K =__
③其他条件不变时,升高温度,c(H2)将__
A 大 B 小 C 变
(3)常温下,现有0.1mol/L FeCl3溶液:
①该溶液呈___(填“酸性”、 “碱性”或“中性");
②为沉淀Fe3+,加入定量氨水调节pH,当c(Fe3+)= 4.0×10-5mol/L时,溶液的pH=__( 已知Ksp[Fe(OH)3]= 4.0×10-38)。
(4)如图是电解CuSO4溶液的装置示意图。a、b是电源的两极,x、y都是石墨电极。通电一段时间后,y极上有气泡产生。试回答下列问题:①电源的正极是__(填 “a”或“b”);②有关溶液变化的描述正确的是______;
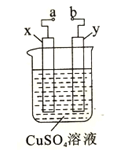
A.pH降低
B.SO42-浓度减小
C.Cu2+浓度增大
③x极的电极反应式为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家结合实验与计算机模拟结果,研究了在铁掺杂W18O49纳米反应器催化剂表面上实现常温低电位合成氨,获得较高的氨产量和法拉第效率。反应历程如图所示,其中吸附在催化剂表面的物种用*标注。
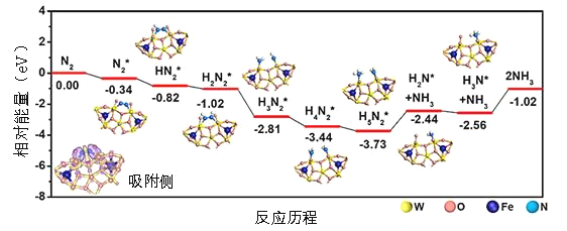
(1)需要吸收能量最大的能垒(活化能)E=__ev,该步骤的化学方程式为___;
(2)对于合成氨反应N2+3H2![]() 2NH3,在标况下,平衡常数Kθ=
2NH3,在标况下,平衡常数Kθ=![]() ,其中pθ为标准压强(1×105Pa),p(NH3)、p(N2)和p(H2)为各组分的平衡分压[已知p(NH3)=x(NH3)p,其中p为平衡总压,x(NH3)为平衡系统中NH3的物质的量分数]。
,其中pθ为标准压强(1×105Pa),p(NH3)、p(N2)和p(H2)为各组分的平衡分压[已知p(NH3)=x(NH3)p,其中p为平衡总压,x(NH3)为平衡系统中NH3的物质的量分数]。
①若起始N2和H2物质的量之比为1:3,反应在恒定温度和标准压强下进行,达到平衡时H2的转化率为ɑ,则Kθ=___(用含ɑ的最简式表示)。
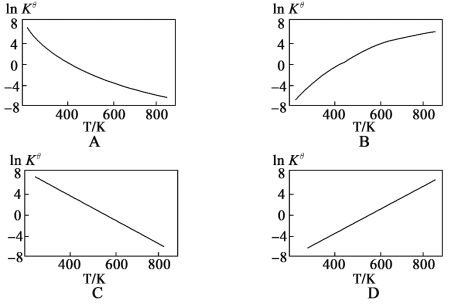
②图中可以示意标准平衡常数Kθ随温度T变化趋势的是___(填序号).
(3)利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如图所示。
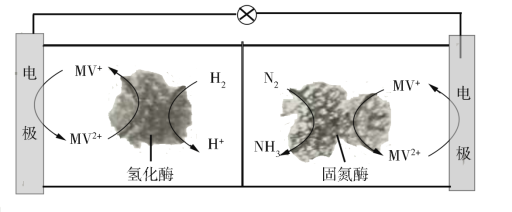
该电池工作时,正极的电极反应为___。中间所用的交换膜应该为___(填“阳离子交换膜”或“阴离子交换膜”或“质子交换膜”)。相比现有工业合成氨,该方法的优点是:___。(任写一条)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,用0.1000 mol· L -1的NaOH溶液滴定0. 1000 mol· L -1的顺丁烯二酸H2A的滴定曲线如下图所示(pKa= lgKa),下列说法错误的是
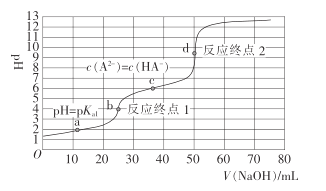
A.用NaOH溶液滴定NaHA溶液可用酚酞作指示剂
B.a点:c(HA-)=c(H2A)
C.H2A的Ka2=10-6
D.d点:c(Na+)<c(HA-)+2c(A2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示的装置中,通电5min后,铜电极的质量增加2.16g。试回答下列问题:
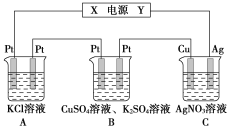
(1)电源中X极为直流电源的__极。
(2)溶液pH的变化情况:A__,B__,C__(填“增大”“减小”或“不变”)。
(3)通电5min后,B装置中共收集224mL(标准状况下)气体,溶液体积为200mL,则通电前该装置溶液中CuSO4的物质的量浓度为__(设电解前后溶液体积无变化)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com