
 某化学兴趣小组为了测定某草酸晶体的纯度及硫酸酸化的高锰酸钾溶液与草酸(H2C2O4)溶液反应的化学反应速率大小的影响因素,设计了如下实验.化学反应如下:
某化学兴趣小组为了测定某草酸晶体的纯度及硫酸酸化的高锰酸钾溶液与草酸(H2C2O4)溶液反应的化学反应速率大小的影响因素,设计了如下实验.化学反应如下:分析 (1)①酸性高锰酸钾溶液具有强氧化性,能氧化草酸根离子生成二氧化碳,同时自身被还原生成二价锰离子,根据氧化还原反应得失电子守恒配平反应方程式;
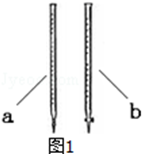
②KMnO4溶液具有强氧化性,可以腐蚀橡皮管,应装在酸式滴定管中;
③草酸反应完毕,滴加最后一滴KMnO4溶液时,溶液呈紫红(微红)色且半分钟不褪色,说明达到终点;
④由关系式2KMnO4~5H2C2O4计算,注意溶液体积变化;
⑤由关系式2KMnO4~5H2C2O4可知V(KMnO4)•c(KMnO4)=$\frac{2}{5}$V(H2C2O4)•c(H2C2O4),即c(H2C2O4)=$\frac{5}{2}$×$\frac{C(KMn{O}_{4})•V(KMn{O}_{4})}{V({H}_{2}{C}_{2}{O}_{4})}$,据此分析判断;
(2)①改变条件后与原条件进行对比;
②根据V=$\frac{△C}{△t}$计算,注意判断过量.
解答 解:(1)①酸性高锰酸钾溶液具有强氧化性,能氧化草酸根离子生成二氧化碳,同时自身被还原生成二价锰离子,离子反应方程式为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O,
故答案为:5H2C2O4+2MnO4-+6H+=1OCO2↑+2Mn2++8H2O;
②KMnO4溶液具有强氧化性,可以腐蚀橡皮管,应装在酸式滴定管中,甲为酸式滴定管,故答案为:甲;
③高锰酸钾本身有颜色,故不需要另加指示剂,草酸反应完毕,滴加最后一滴KMnO4溶液时,溶液呈紫红(微红)色且半分钟不褪色,说明达到终点,
故答案为:滴加最后一滴KMnO4溶液时,溶液呈紫红(微红)色且半分钟不褪色,说明达到终点;
④由关系式 2KMnO4~5H2C2O4可知
2 5
0.1000mol•L-1×0.0200L n
n=0.005mol
100mL草酸溶液中草酸物质的量0.005mol×$\frac{100}{25}$=0.02mol
草酸晶体的质量分数=$\frac{0.02mol×126g•mo{l}^{-1}}{2.80g}$×100%=90%;
故答案为:90%;
⑤由关系式2KMnO4~5H2C2O4可知V(KMnO4)•c(KMnO4)═$\frac{2}{5}$V(H2C2O4)•c(H2C2O4),即c(H2C2O4)=$\frac{5}{2}$×$\frac{C(KMn{O}_{4})•V(KMn{O}_{4})}{V({H}_{2}{C}_{2}{O}_{4})}$,
A.读取KMnO4溶液体积时,滴定前平视,滴定结束后俯视读数,导致酸性高锰酸钾溶液的体积读数偏小,测定的测定草酸的浓度偏低,故A不符合;
B.滴定管内在滴定前有气泡,滴定后气泡消失,导致酸性高锰酸钾溶液的体积读数偏大,测定的草酸浓度偏高,故B符合;
C.锥形瓶用蒸馏水洗净后润洗,导致草酸的物质的量增加,所用高锰酸钾的体积增大,测定的草酸浓度偏高,故C符合;
D.滴定过程中加入少量蒸馏水冲洗瓶壁,对草酸的物质的量无影响,所用高锰酸钾体积不变,对测定草酸浓度无影响,故D不符合;
故选BC;
(2)①实验的目的是看温度对反应速率的影响,故需与常温进行对照,故答案为:对照;
②试管中加入2mL 0.1mol.L-1酸性KMnO4 溶液,再向试管中同时加入2mL 0.1mol.L-1H2C2O4,根据关系式:2KMnO4~5H2C2O4可知高锰酸钾过量,反应完全时,
2KMnO4 ~5H2C2O4
2 5
△n(KMnO4) 0.1mol•L-1×2×10-3L
△n(KMnO4)=$\frac{0.1mol•{L}^{-1}×2×1{0}^{-3}L×2}{5}$=0.08×10-3mol
混合后△c(KMnO4)=$\frac{0.08×1{0}^{-3}mol}{(2+2)×1{0}^{-3}L}$=0.02mol/L,v((KMnO4)=$\frac{△C}{△t}$=$\frac{0.02mol•{L}^{-1}}{10s}$0.002mol/(L•s),故答案为:0.002mol/(L•s).
点评 本题考查氧化还原滴定原理与应用、探究影响速率的因素,难度中等,理解实验原理是解题的关键,是对知识的综合运用,需要学生具备扎实的基础知识与运用知识分析问题、解决问题的能力,特别注意最后的一道计算题,要对过量问题进行判断,很容易出错.


 应用题作业本系列答案
应用题作业本系列答案 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | R的氧化物一定能溶于水 | |
| B. | R的最高价氧化物对应水化物是H2RO3 | |
| C. | R的氢化物的水溶液呈碱性 | |
| D. | R的氧化物都能与NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某探究小组用酸性KMnO4溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素.实验条件作如下限定:催化剂的用量可选择0.5g、0g,酸性KMnO4溶液的浓度可选择0.01mol•L-1、0.001mol•L-1,实验温度可选择298K、323K.每次实验KMnO4酸性溶液的用量均为4mL,H2C2O4溶液(0.1mol•L-1 )的用量均为2mL.
某探究小组用酸性KMnO4溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素.实验条件作如下限定:催化剂的用量可选择0.5g、0g,酸性KMnO4溶液的浓度可选择0.01mol•L-1、0.001mol•L-1,实验温度可选择298K、323K.每次实验KMnO4酸性溶液的用量均为4mL,H2C2O4溶液(0.1mol•L-1 )的用量均为2mL.| 实验编号 | T/K | 催化剂的用量/g | KMnO4酸性溶液的浓度/mol•L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.01 | (Ⅰ)实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究催化剂对该反应速率的影响 |
| ② | ||||
| ③ | ||||
| ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室用H2O2分解反应制取氧气时,常加入催化剂以加快反应速率,某研究性学习小组为研究催化剂FeCl3的量对O2生成速率的影响,设计了如下三组实验方案(见下表),将表中所给的试剂按一定体积混合后进行反应.
实验室用H2O2分解反应制取氧气时,常加入催化剂以加快反应速率,某研究性学习小组为研究催化剂FeCl3的量对O2生成速率的影响,设计了如下三组实验方案(见下表),将表中所给的试剂按一定体积混合后进行反应.| 实验编号 试剂 | A | B | C |
| 10% H2O2/mL | 20.0 | V1 | V2 |
| 2mol/L FeCl3/mL | 0 | 5.0 | 10.0 |
| H2O/mL | V3 | V4 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | SiCl4 | AlCl3 | FeCl3 |
| 沸点/℃ | 57.7 | - | 315 |
| 熔点/℃ | -70.0 | - | - |
| 升华温度/℃ | - | 180 | 300 |
| 序号 | 操作 | 可能出现的现象 | 结论 |
| ① | 向a试管中滴加几滴0.01mol/L的KMnO4(或溴水)溶液 | 若溶液褪色 | 则假设1成立 |
| 若溶液不褪色 | 则假设2或3成立 | ||
| ② | 向b试管中滴加几滴品红溶液 | 若溶液褪色 | 则假设1或3成立 |
| 若溶液不褪色 | 则假设2成立 | ||
| ③ | 向c试管中滴加几滴淀粉-KI溶液 | 若溶液变为蓝色 | 则假设3成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧根离子的电子式是: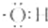 | B. | 甲烷分子的比例模型是: | ||
| C. | 硝基的表示方法-NO2 | D. | 饱和烃的通式是CnH2n+2(n≥1) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 发生装置与氯酸钾制取氧气相同 | |
| B. | 可以用碱石灰干燥氨气 | |
| C. | 棉花的作用和高锰酸钾制取氧气一样 | |
| D. | 氨气验满的方法是将湿润的红色石蕊试纸放于集气瓶附近 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
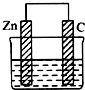 一个由锌片和石墨棒作为电极的原电池如图所示,电极反应分别是:
一个由锌片和石墨棒作为电极的原电池如图所示,电极反应分别是:| A. | 电子从石墨经外电路流向锌片,电解质溶液为酸性溶液 | |
| B. | 锌片是负极,石墨是正极 | |
| C. | 电池总反应为2Zn+O2═2ZnO | |
| D. | 该原电池工作一段时间后石墨附近溶液中的c(OH-)增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com