
分析 根据n=$\frac{m}{M}$计算6.5g Zn的物质的量,根据方程式:Zn+2HCl=ZnCl2+H2↑,计算生成氢气的物质的量,根据V=nVm计算氢气的体积,结合Zn化合价计算转移电子物质的量.
解答 解:(1)6.5g Zn的物质的量=$\frac{6.5g}{65g/mol}$=0.1mol,
设生成氢气的物质的量为x,则:
Zn+2HCl=ZnCl2+H2↑
1 1
0.1mol x
x=$\frac{0.1mol×1}{1}$=0.1mol
标况下,生成氢气的体积=0.1mol×22.4L/mol=2.24L,
故答案为:2.24L;
(2)反应中Zn由0价升高为+2价,故转移电子为0.1mol×(2-0)=0.2mol,
答:反应中转移电子为0.2mol.
点评 本题考查化学方程式的计算,比较基础,有利于基础知识的巩固.


科目:高中化学 来源: 题型:选择题
| A. | 有能量变化的都是化学变化 | |
| B. | 物质发生化学变化并不一定都伴随着能量变化 | |
| C. | 用实验方法和理论方法研究反应热的化学称为热化学 | |
| D. | 任何反应中的能量变化都表现为热量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时应使温度计水银球与蒸馏烧瓶支管口平齐 | |
| C. | 蒸发时,待蒸发皿中没有水了再停止加热 | |
| D. | 称量氢氧化钠时,应先将小烧杯放在左盘称量,再将药品加入到小烧杯中称量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验用品 | 溶液温度 | 中和热 | ||
| t1 | t2 | △H | ||
| ① | 50 mL0.55 mol•L-1NaOH溶液 | 20℃ | 23.3℃ | |
| 50 mL0.5 mol•L-1HCl溶液 | ||||
| ② | 50 mL0.55 mol•L-1NaOH溶液 | 20℃ | 23.5℃ | |
| 50 mL0.5 mol•L-1HCl溶液 | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气与水反应:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 氢氧化铝与盐酸:Al(OH)3+3H+═Al3++3H2O | |
| C. | 铁溶于氯化铁溶液:Fe+Fe3+═2Fe2+ | |
| D. | 氨气溶于醋酸:H++NH3═NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 、醛基-CHO、羧基-COOH、-COOR酯基.
、醛基-CHO、羧基-COOH、-COOR酯基.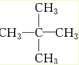 ,名称为2,2-二甲基丙烷.
,名称为2,2-二甲基丙烷.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HX、HY、HZ的酸性依次增强 | |
| B. | 溶液中的离子浓度c(X-)<c(Y-)<c(Z-) | |
| C. | 电离常数K(HY)>K(HZ),水解常数K(Y-)>K(Z-) | |
| D. | c(X-)=c(Y-)+c(HY)=c(Z-)+c(HZ) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com