
| A. | 由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀 | |
| B. | Ksp只与难溶电解质的性质和温度有关 | |
| C. | 其他条件不变,离子浓度改变时,Ksp不变 | |
| D. | 两种难溶电解质,Ksp小的,溶解度一定小 |
分析 A.化学反应平衡常数只与反应本身的性质和温度有关,与溶液中离子浓度无关;
B.从难溶电解质的溶解平衡的角度分析;
C.Ksp只受温度的影响;
D.Ksp小的,溶解度不一定小.
解答 解:A.化学反应平衡常数只与反应本身的性质和温度有关,当难溶物确定时就只和温度有关了,故A正确;
B.由于Ksp(ZnS)>Ksp(CuS),在ZnS饱和溶液中加入Cu2+溶液,可生成CuS沉淀,故B正确;
C.Ksp只受温度的影响,与浓度无关,故C正确;
D.对于阴、阳离子的个数比相同即同一类型的难溶电解质,Ksp的数值越大,难溶电解质在水中的溶解能力越强即溶解度越大.对于阴、阳离子的个数比不同的难溶电解质,不能直接用Ksp的大小比较它们的溶解能力,必须通过计算进行比较,故D错误;
故选D.
点评 本题考查难溶电解质的溶解平衡及其影响,侧重于平衡常数的含义与应用的理解,题目难度中等,易错点为D,注意不同类型的难溶物的化学计量数不同,它作为各离子浓度的次方数对Ksp的影响有很大差别,所以不能用这两种Ksp的相对大小来比较难溶物的溶解度,试题培养了学生的灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 物质 | X | Y | Z |
| 初始浓度/mol•L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol•L-1 | 0.05 | 0.05 | 0.1 |
| A. | 反应达到平衡时,X的转化率为50% | |
| B. | 反应可表示为X(g)+3Y(g)?2Z(g),其平衡常数为1600 (L/mol)2 | |
| C. | 增大压强,平衡常数增大 | |
| D. | 改变温度可以改变此反应的平衡常数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

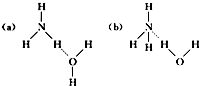
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:A>B>C>D | B. | 原子序数:b>a>c>d | ||
| C. | 离子半径:D>C>B>A | D. | a+1=d-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
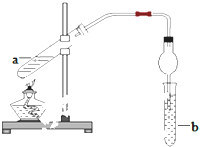 如图,在试管a中先加入2mL95%的乙醇,再加入3mL无水醋酸,边摇边缓缓加入2mL浓H2SO4,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管b中加入5mL饱和碳酸钠溶液.连接好装置.用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验.
如图,在试管a中先加入2mL95%的乙醇,再加入3mL无水醋酸,边摇边缓缓加入2mL浓H2SO4,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管b中加入5mL饱和碳酸钠溶液.连接好装置.用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验. CH3COOC2H5+H2O.
CH3COOC2H5+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,离子键,共价键;
,离子键,共价键;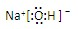 ,离子键,共价键;
,离子键,共价键; ;共价键;
;共价键; ,共价键,离子键.
,共价键,离子键.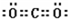 ;共价键;
;共价键; ;共价键.
;共价键.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 氢氧化物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
| Ksp | 2.2×10-20 | 4.0×10-38 | 8.0×10-16 | 1.8×10-11 |
| 温度(K) | 平衡时NH3的物质的量(mol) |
| T1 | 2.4 |
| T2 | 2.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com