
����Ŀ��ijѧ����0.2000mol��L-1�ı�NaOH��Һ�ζ�δ֪Ũ�ȵ����ᣬ��������£�
![]()
�� ������ˮϴ�Ӽ�ʽ�ζ��ܣ�������ע��NaOH��Һ����0���̶������ϣ�
�� �̶��õζ��ܲ�ʹ�ζ��ܼ������Һ�壻
�� ����Һ������0����0���̶������£������¶�����
�� ��ȡ20.00mL����Һע��ྻ����ƿ�У�������3�η�̪��Һ��
�� �ñ�Һ�ζ����յ㣬���µζ���Һ�������
��ش�
��1�����ϲ���������ǣ����ţ�____�����ⶨ���ƫ�ߣ���ԭ�������______��
A�����Ʊ���Һ�Ĺ���NaOH�л���KOH����
B���ζ��յ����ʱ�����ӵζ��ܵĿ̶ȣ�����������ȷ
C��ʢװδ֪Һ����ƿ������ˮϴ��������δ֪Һ��ϴ
D���ζ����յ����ʱ�����ֵζ��ܼ��촦����һ����Һ
��2���жϵζ��յ��������____________________________��
��3������ͼ��ij�εζ�ʱ�ĵζ����е�Һ�棬�����Ϊ________mL��
��4�������������ݣ���������������Һ��Ũ��______mol/L��
�ζ����� | ���������mL�� | ���ռ������mL�� | |
�ζ�ǰ���� | �ζ������ | ||
��һ�� | 20.00 | 0.40 | 20.40 |
�ڶ��� | 20.00 | 2.00 | 24.10 |
������ | 20.00 | 4.00 | 24.00 |
���𰸡� �� AD �������һ������������Һ����Һ����ɫ��Ϊdz��ɫ���ұ���30�벻��ɫ 22.60 0.2000
����������1����ʽ�ζ���Ӧ������������ˮ��ϴ��Ȼ���ñ�NaOH��Һ��ϴ�������Ӱ���Һ��Ũ�ȣ��ʵ������������Ʊ���Һ�Ĺ���NaOH�л���KOH����������Һ�����������ӵ�Ũ��ƫС,���ĵ�V(��)������![]() ���ⶨ���ƫ��,����Aѡ������ȷ�����ζ��յ����ʱ,���ӵζ��ܵĿ̶�,���ĵ�V(��)ƫС����
���ⶨ���ƫ��,����Aѡ������ȷ�����ζ��յ����ʱ,���ӵζ��ܵĿ̶�,���ĵ�V(��)ƫС����![]() �������ⶨ���ƫ��������B������ʢװδ֪Һ����ƿ������ˮϴ��������δ֪Һ��ϴ�����ĵ�V(��)������
�������ⶨ���ƫ��������B������ʢװδ֪Һ����ƿ������ˮϴ��������δ֪Һ��ϴ�����ĵ�V(��)������![]() �������ⶨ�������,��C�������ζ����յ����ʱ�����ֵζ��ܼ��촦����һ����Һ�����ĵ�V(��)ƫ����
�������ⶨ�������,��C�������ζ����յ����ʱ�����ֵζ��ܼ��촦����һ����Һ�����ĵ�V(��)ƫ���� ![]() �������ⶨ���ƫ��������Dѡ������ȷ������ȷѡ��.AD��
�������ⶨ���ƫ��������Dѡ������ȷ������ȷѡ��.AD��
��2���ζ��յ�������������������һ��NaOH��Һʱ����ƿ����Һ����ɫ��Ϊdz��ɫ���ұ���30�벻��ʧ����ȷ�𰸣��������һ������������Һ����Һ����ɫ��Ϊdz��ɫ������30�벻��ʧ��
��3���ζ����е�Һ�����Ϊ![]() ����ȷ����22.60��
����ȷ����22.60��
��4�����εζ����ĵ����Ϊ20.00mL ��22.1 mL��20.00mL���ڶ������ݲ����������������������Ƶ����![]() ������
������![]() =0.2��20��10-3/20��10-3= 0.2000 mol/L����ȷ�𰸣�0.2000��
=0.2��20��10-3/20��10-3= 0.2000 mol/L����ȷ�𰸣�0.2000��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ���ɺ����������࣬CaO����
�ٻ����� �ڻ���� �۽��������� �ܷǽ��������� ������������ ����������
A.�ڢ�B.�٢ܢ�C.�٢ۢ�D.�ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��NaCl��Na2CO3��10H2O��NaHCO3�Ļ���ijͬѧ�������ʵ�飬ͨ��������Ӧǰ��C��Dװ�������ı仯���ⶨ�û�����и���ֵ�����������

��1������ǰͨ�뵪����Ŀ����_____________����������Ϊ____________ ��
��2��װ��A��C��D��ʢ�ŵ��Լ��ֱ�ΪA_______��C________��D_______��
��3������Aװ�û���ʢ��NaOH��Һ��ϴ��ƿ�����õ�NaCl�ĺ�����_______������ƫ��������ƫ����������Ӱ��������ͬ������B�з�Ӧ���Ҳ���ˮ������������ⶨ�����NaHCO3�ĺ�����________��
��4������Ʒ����Ϊwg����Ӧ��C��D���ӵ������ֱ�Ϊm1g��m2g���ɴ˿�֪�������Na2CO3��10H2O����������Ϊ_______���ú�w��m1��m2�Ĵ���ʽ��ʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������Ҫ�е��ߡ��Ŵ���Ϣ��Я���ߡ���Ҫ��Դ���ʡ���Ҫ��������������(����)
A. ���ᡢ�����ʡ�֬��������
B. �����ʡ����ᡢ���ࡢ֬��
C. ���ᡢ�����ʡ����ࡢ֬��
D. �����ʡ�֬�������ᡢ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о���Ա���Ƴ�һ�ֿ���Ϊ����DZͧ�Ĵ�����Դ�����͵�ء����ˮ���(�ṹ��ͼ)��ʹ��ʱ����ˮ���ɷŵ硣���й��ڸõ�ص�˵������ȷ����(����)
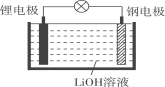
A. �Ϊ��������Ϊ����B. ����ʱ�����ĵ缫��ӦʽΪLi��e����Li��
C. ����ʱOH����ֵ缫�ƶ�D. �ŵ�ʱ���ӵ�����﮵缫�����ߡ��ֵ缫
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������A������ B�������� C�������� D ��ʯ�� E ������������
����������е�֪ʶ��ѡ����ʵ����ʣ�����ĸ������գ�
��1������������__________��
��2��������Ʒ�ijɷ���__________��
��3�����ڼ����__________��
��4������ɫ������__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ���������ܼ��š��͡���̼���á���Ŀǰ��ҵ����һ�ַ�������CO2������ȼ���Ҵ���һ�������·�����Ӧ��2CO2(g)��6H2(g)![]() CH3CH2OH(g)��3H2O(g)����H<0��
CH3CH2OH(g)��3H2O(g)����H<0��
��1����һ�������£���20 L�ܱ������а����ʵ�����Ϊ1��3����CO2��H2���¶���450 K��n(H2)��ʱ��仯�����ʾ��
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8 | 6 | 5 | 5 |
��450 �桢0��1 min��v(CH3CH2OH)��________�����¶��¸÷�Ӧ�Ļ�ѧƽ�ⳣ��Ϊ________(���������λ��Ч����)��
��2����5 MPa�²��ƽ����ϵ�и����ʵ�����������¶ȵı仯������ͼ��ʾ��

�����ұ�ʾ���� ________(�����ʵĻ�ѧʽ)�����������ͼ����A���Ӧ���������b��________%(���������λ��Ч����)��
��3�����д�ʩ����ʹ��ѧƽ��������Ӧ�����ƶ�����________��
A�������¶�
B����CH3CH2OH(g)��ʱҺ�����
C��ѡ���Ч����
D���ٳ���l mol CO2��3 mol H2
��4��25 �桢1.01��105Paʱ��9.2 gҺ̬�Ҵ���ȫȼ�գ����ָ���ԭ״̬ʱ���ų�273.4 kJ��������д����ʾ�Ҵ�ȼ�յ��Ȼ�ѧ����ʽ��________________________��
��5����ʯīΪ�缫���������ơ��Ҵ���ˮ������Ϊԭ�ϣ������Ƴ��Ҵ���ȼ�ϵ�أ�д��������ԭ��Ӧ�ĵ缫��Ӧʽ��_____________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ظ������һ����Ҫ�Ļ���ԭ�ϣ���ҵ���ɸ�������Ҫ�ɷ�ΪFeOCr2O3��SiO2�ȣ��Ʊ����Ʊ�������ͼ��ʾ��
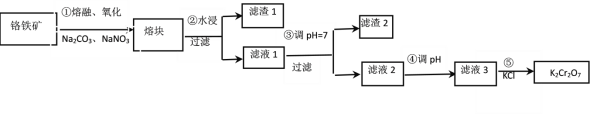
��֪��a.����ٵ���Ҫ��ӦΪ��2FeOCr2O3+4Na2CO3+ 7NaNO3 ![]() 4Na2CrO4+Fe2O3+4CO2+7NaNO2��b. 2CrO42-+2H+
4Na2CrO4+Fe2O3+4CO2+7NaNO2��b. 2CrO42-+2H+ ![]() Cr2O72-+H2O������˵����ȷ����
Cr2O72-+H2O������˵����ȷ����
A. ��������ڡ������������մ������н���
B. �������ÿ����44.8L CO2��ת��7mol����
C. �������������Һ2��pHʹ֮��С��������������Cr2O72��
D. ���������K2Cr2O7���壬˵�����¶���K2Cr2O7�ܽ��С��Na2Cr2O7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڻ�ҩ���й��Ŵ����Ĵ���֮һ���䱬ը���Ȼ�ѧ����ʽΪ:S(s)+2KNO3(s)+3C(s)=K2S(s)+N2(g)+3CO2(g) ��H=xkJ��mol-l
��֪:��C(s)+O2(g)=CO2(g) ��H=akJ��mol-l
��K2S(s)=S(s)+2K(s) ��H=bkJ��mol-l
��2K(s)+N2(g)+3O2(g)=2KNO3(s) ��H=ckJ��mol-l
����˵����ȷ����
A. x>0 a<0
B. b<0 c<0
C. x=3a-b-c
D. 1mol ̼(s)�ڿ����в���ȫȼ������CO���ʱ�С��akJ��mol-1
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com