

分析 实验I:(1)用石墨作电极电解饱和食盐水制取次氯酸钠溶液,由图可知,b应为正极,电解池的下端为阳极,阳极上氯离子放电生成氯气,易与阴极产生的NaOH反应;
(2)氯气与NaOH反应生成氯化钠、NaClO、水;
实验II:由图可知,装置②中发生氧化还原反应,且生成二氧化碳,则装置①和⑥可排除空气中的CO2对实验的干扰,酸性条件下,次氯酸根离子和氯离子反应生成氯气,氯气具有强氧化性,能氧化碘离子生成碘单质,在装置③中可除去氯气,装置④可干燥二氧化碳,装置⑤中反应生成碳酸钡沉淀,且继续通过将净化的空气,将装置内的残留的二氧化碳全部进入装置⑤,以减少实验误差,再结合原子守恒及化学反应可测定含氰废水处理百分率,以此来解答.
解答 解:(1)由图可知,b应为正极,电解池的下端为阳极,阳极上氯离子放电生成氯气,易与阴极产生的NaOH反应,且a电极连接的电极为阴极,则a为原电池负极,
故答案为:负极;
(2)氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,离子反应方程式为Cl2+2OH-=ClO-+Cl-+H2O,
故答案为:Cl2+2OH-=ClO-+Cl-+H2O;
(3)根据装置①⑥中试剂的性质和装置位置知,其作用为防止空气中二氧化碳对实验结果造成干扰,所以其作用是排除空气中的二氧化碳对实验的干扰,
故答案为:排除空气中的二氧化碳对实验的干扰;
(4)根据已知装置②中发生的主要反应依次为CN-+ClO-═CNO-+Cl-、2CNO-+2H++3ClO-═N2↑+2CO2↑+3Cl-+H2O,可知溶液中有氯离子、氢离子和次氯酸根离子,酸性条件下,氯离子和次氯酸根离子反应生成氯气,产生的氯气用碘化钾吸收,所以发生的离子反应方程式为ClO-+Cl-+2H+=Cl2↑+H2O,
故答案为:ClO-+Cl-+2H+=Cl2↑+H2O;
(5)反应后装置中残留二氧化碳,应继续通过将净化的空气,将装置内的残留的二氧化碳全部进入装置⑤,以减少实验误差,
故答案为:使装置中残留的二氧化碳全部进入装置⑤.
点评 本题考查物质的制备实验及含量测定,为高频考点,把握实验装置的作用、反应原理、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的严密性及元素化合物知识的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 8种 | B. | 9种 | C. | 10种 | D. | 12种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
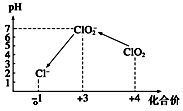 二氧化氯是一种黄绿色到橙黄色的气体,被国际上公认为安全、低毒的绿色消毒剂,近几年我国用ClO2代替氯气对饮用水进行消毒.
二氧化氯是一种黄绿色到橙黄色的气体,被国际上公认为安全、低毒的绿色消毒剂,近几年我国用ClO2代替氯气对饮用水进行消毒.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 金属离子 | Fe3+ | Al3+ | ZrO2+ |
| 开始沉淀的pH | 1.9 | 3.3 | 6.2 |
| 沉淀完全的pH | 3.2 | 5.2 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ;Y是火箭发动机的燃料,已知3.2g Y与足量A2C2反应生成两种气态产物,其中一种产物是空气的主要成分,同时放出Q kJ的热量,写出其热化学反应方程式N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-10QkJ/mol.
;Y是火箭发动机的燃料,已知3.2g Y与足量A2C2反应生成两种气态产物,其中一种产物是空气的主要成分,同时放出Q kJ的热量,写出其热化学反应方程式N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-10QkJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com