
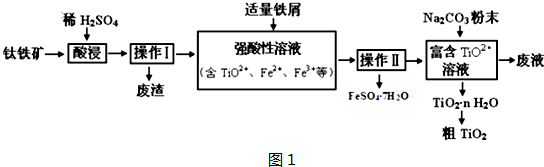
分析 钛铁矿中加入稀硫酸,经充分反应后过滤,所得滤液中含有TiO2+、Fe2+、Fe3+等离子,从溶液中得到硫酸亚铁晶体,应经过蒸发浓缩、冷却结晶,过滤后得到富含的TiO2+溶液,加入Na2CO3粉末与H+反应,降低了溶液中c(H+),使平衡TiO2++(n+1)H2O?TiO2•n H2O+2H+向生成TiO2•n H2O的方向移动,可得到TiO2粗产品,以此解答该题.
解答 解:钛铁矿中加入稀硫酸,经充分反应后过滤,所得滤液中含有TiO2+、Fe2+、Fe3+等离子,从溶液中得到硫酸亚铁晶体,应经过蒸发浓缩、冷却结晶,过滤后得到富含的TiO2+溶液,加入Na2CO3粉末与H+反应,降低了溶液中c(H+),使平衡TiO2++(n+1)H2O?TiO2•n H2O+2H+向生成TiO2•n H2O的方向移动,可得到TiO2粗产品,
(1)由题给反应流程可知TiO2与酸反应生成TiO2+,则反应的离子方程式为TiO2+2H+=TiO2++H2O,加入铁屑,可得到硫酸亚铁晶体,说明加入铁屑的作用是使Fe3+还原为Fe2+,
故答案为:TiO2+2H+=TiO2++H2O;使Fe3+还原为Fe2+;
(2)从溶液中得到硫酸亚铁晶体,应经过蒸发浓缩、冷却结晶,过滤等操作,有时需要洗涤晶体,以除去表面吸附的离子,
故答案为:蒸发浓缩,冷却结晶,过滤(洗涤);
(3)富含的TiO2+溶液,加入Na2CO3粉末与H+反应,降低了溶液中c(H+),使平衡TiO2++(n+1)H2O?TiO2•n H2O+2H+向生成TiO2•n H2O的方向移动,可得到TiO2粗产品,在整个制备流程中分别加入硫酸和碳酸钠,则废液中主要含有硫酸钠,即Na2SO4,
故答案为:溶液中存在水解平衡TiO2++(n+1)H2O?TiO2•n H2O+2H+,加入的Na2CO3粉末与H+反应,降低了溶液中c(H+),促进水解平衡向生成TiO2•n H2O的方向移动;Na2SO4;
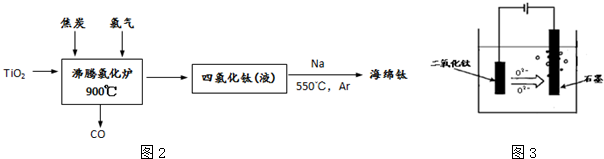
(4)由反应流程可知TiO2、C和Cl2反应生成TiCl4和CO,则反应的化学方程式为TiO2+2C+2Cl2$\frac{\underline{\;900℃\;}}{\;}$TiCl4+2CO,制得的TiCl4液体中常含有少量SiCl4杂质,因二者的沸点不同,可用蒸馏的方法分离,
故答案为:TiO2+2C+2Cl2$\frac{\underline{\;900℃\;}}{\;}$TiCl4+2CO;蒸馏(或分馏);
(5)电解时,阴极发生还原反应生成Ti,电极方程式为TiO2+4e-=Ti+2O2-,阳极发生氧化反应,电极方程式为2O2-+4e-=O2,阳极生成O2,由于阳极材料为石墨,则氧气和石墨反应可生成CO、CO2等,
故答案为:TiO2+4e-=Ti+2O2-;O2、CO、CO2.
点评 本题考查物质的制备、为高考常见题型,侧重于学生的分析能力、实验能力的考查,注意把握实验的原理和目的,为解答该类题目的关键,注意物质的性质,结合题给信息解答,难度中等.


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:选择题
| A. | 18g D2O和18g H2O中含有的质子数均为10NA | |
| B. | ${\;}_{17}^{35}$Cl与${\;}_{17}^{37}$Cl得电子能力相同 | |
| C. | 第IA族元素铯的两种同位素137Cs比133Cs多4个质子 | |
| D. | 中子数为146、质子数为92的铀(U)原子:${\;}_{92}^{146}$U |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
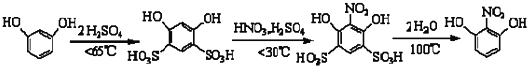
| 名称 | 相对分子质量 | 性状 | 熔点 | 水溶性(常温) |
| 间苯二酚 | 110 | 白色针状晶体 | 110.7 | 易容 |
| 2-硝基-1,3-苯二酚 | 155 | 桔红色针状晶体 | 87.8 | 难溶 |
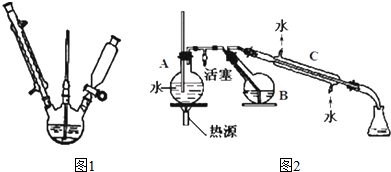
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com