
| A. | 15mol•L-1 | B. | 10mol•L-1 | C. | 5mol•L-1 | D. | 1mol•L-1 |
分析 Al与NaOH溶液反应方程式为2Al+2H2O+2NaOH=2NaAlO2+3H2↑,n(H2)=$\frac{6.72L}{22.4L/mol}$=0.3mol,根据方程式知存在关系式2NaOH----3H2,根据关系式计算c(NaOH).
解答 解:Al与NaOH溶液反应方程式为2Al+2H2O+2NaOH=2NaAlO2+3H2↑,n(H2)=$\frac{6.72L}{22.4L/mol}$=0.3mol,根据方程式知存在关系式2NaOH----3H2,根据关系式得c(NaOH)=$\frac{\frac{0.3mol}{3}×2}{0.02L}$=10mol/L,故选B.
点评 本题考查化学方程式有关计算,为高频考点,侧重考查学生分析计算能力,正确书写方程式是解本题关键,注意关系式的灵活运用,题目难度不大.


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 W、Y、Z、Q、R是周期表中前四周期的元素,且原子序数依次增大.基态W的原子核外有2个未成对电子,Q是电负性最大的元素,基态R的原子核外未成对电子数是W原子核外未成对电子数的2倍.请问答下列问题(答题时,W、Y、Z、Q、R用所对应的元素符号表示):
W、Y、Z、Q、R是周期表中前四周期的元素,且原子序数依次增大.基态W的原子核外有2个未成对电子,Q是电负性最大的元素,基态R的原子核外未成对电子数是W原子核外未成对电子数的2倍.请问答下列问题(答题时,W、Y、Z、Q、R用所对应的元素符号表示):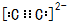 ,基态R原子的价电子排布式为2s22p4.
,基态R原子的价电子排布式为2s22p4.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若混合后溶液pH=7,则c(M+)=c(Cl-) | |
| B. | 若b=2a,则c(Cl-)>c(M+)>c(H+)>c(OH-) | |
| C. | 若a=2b,则c(M+)>c(Cl-)>c(OH-)>c(H+) | |
| D. | 若混合后溶液满足c(H+)=c(OH-)+c(MOH),则可推出a=b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、NO3-、Al3+、Cl- | B. | Na+、Al3+、S2-、NO3- | ||
| C. | MnO4-、K+、SO42-、Na+ | D. | K+、SO42-、HCO3-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化合物 | 密度/g•cm-3 | 沸点/℃ | 溶解性 |
| 正丁醇 | 0.810 | 118.0 | 可溶 |
| 冰醋酸 | 1.049 | 118.1 | 互溶 |
| 乙酸正丁酯 | 0.882 | 126.1 | 微溶 |
| 乙醇 | 0.79 | 78.5 | 互溶 |
| 乙酸乙酯 | 0.88 | 77.06 | 可溶 |
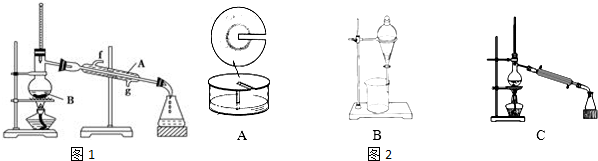
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
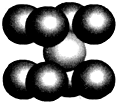 已知A、B、R、D都是周期表中前四周期的元素,它们的原子序数依次增大.其中A元素基态原子第一电离能比B元素基态原子的第一电离能大,B的基态原子的L层、R基态原子的M层均有2个单电子,D是第Ⅷ族中原子序数最小的元素.
已知A、B、R、D都是周期表中前四周期的元素,它们的原子序数依次增大.其中A元素基态原子第一电离能比B元素基态原子的第一电离能大,B的基态原子的L层、R基态原子的M层均有2个单电子,D是第Ⅷ族中原子序数最小的元素.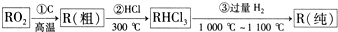
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔是国际科学界建议采用的一种物理量 | |
| B. | 物质的摩尔质量等于该物质的相对分子质量 | |
| C. | O22-离子的摩尔质量是32 g•mol-1 | |
| D. | 1 mol H2O的质量为18 g•mol- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com