
 H++OH-,下列叙述中正确的是
H++OH-,下列叙述中正确的是| A.升高温度,KW增大,pH不变 |
| B.向水中加入少量稀硫酸,c(H+)增大,KW不变 |
| C.向水中加入氨水,平衡逆向移动,c(OH-)降低 |
| D.向水中加入少量同体CH3COONa,平衡逆向移动,c (H+)降低 |
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源:不详 题型:单选题
| A.c(Na+)> c(HCO3-)> c(CO32-)> c(H+)> c(OH-) |
| B.c(Na+)> c(CO32-)> c(HCO3-)> c(OH-)> c(H+) |
| C.c(Na+)= c(HCO3-) + 2c(CO32-) + c(H2CO3 |
| D.c(Na+) + c(H+)= c(HCO3-) + 2c(CO32-) + c(OH-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2CO(g) +O2(g) ==2CO2(g)△H=—566.0 kJ/mol |
| B.C(s) +1/2O2(g) ==CO(g)△H=—110.5 kJ/mol |
| C.CH4(g) +2O2(g)="=" CO2(g)+2H2O(l)△H=—890.31 kJ/mol |
| D.2C8H18(l) +25O2(g)==16CO2(g)+18H2O(l)△H=—11036 kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 H+ + A2-。
H+ + A2-。A.c(Na+)>c(A2-)>c( OH-)>c(HA-)>c(H+) OH-)>c(HA-)>c(H+) |
| B.c(Na+)>c(OH-)>c(HA-)>c(A2-)>c(H+) |
| C.c(Na+)>c(H+)>c(A2-)>c(OH-)>c(HA-) |
| D.c(A2-)>c(Na+)>c(OH-)>c(H+)>c(HA-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NaCl-HCl | B.NaHCO3-H2CO3 |
| C.NaOH-HCl | D.Na2CO3-HCl |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸 |
| B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| C.酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数 |
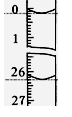
| 滴定 次数 | 待测NaOH溶液的体积/mL | 0.1000 mol/L盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 平均耗用盐酸 体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.15 | ①V=__________ |
| 第二次 | 25.00 | 0.56 | 30.30 | |
| 第三次 | 25.00 | 0.20 | 26.45 | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| B.c(HCO3-)=c(Na+)>c(OH-)>c(H+) |
| C.c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) |
| D.c(OH-)=c(HCO3-)+2c(H2CO3)+c(H+) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com