
标准状况下,某同学向100 mLH2S饱和溶液中通入SO2,所得溶液pH变化如图所示,下列分析中,正确的是( )。

A.ab段反应是:SO2+2H2S===3S↓+2H2O
B.亚硫酸是比氢硫酸更弱的酸
C.原H2S溶液的物质的量浓度为0.05 mol/L
D.b点对应的溶液导电性最强
科目:高中化学 来源: 题型:
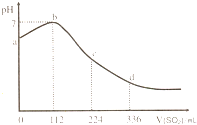 标准状况下,某同学向 100mL H2S 饱和溶液中通入SO2,所得溶液pH变化如图所示.下列分析中,正确的是( )
标准状况下,某同学向 100mL H2S 饱和溶液中通入SO2,所得溶液pH变化如图所示.下列分析中,正确的是( )| A、ab 段的反应是:SO2+2H2S=3S↓+2 H2O | B、b 点对应的溶液导电性最强 | C、原H2S溶液的物质的量浓度为0.1mol?L-1 | D、bd段对应的溶液呈酸性的原因是:H2SO3=2H++SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 标准状况下,某同学向 100 mL H2S 饱和溶液中通入SO2,所得溶液pH变化如图所示。下列分析中,正确的是
标准状况下,某同学向 100 mL H2S 饱和溶液中通入SO2,所得溶液pH变化如图所示。下列分析中,正确的是![]() 学科网
学科网
A.ab 段的反应是:SO2 + 2H2S=3S↓+2 H2O ![]() 学科网
学科网
B.b 点对应的溶液导电性最强![]() 学科网
学科网
C.原H2S溶液的物质的量浓度为0.1mol·L-1 ![]() 学科网
学科网
D.bd段对应的溶液呈酸性的原因是:H2SO3 = 2H+ + SO32-![]() 学科网
学科网
查看答案和解析>>
科目:高中化学 来源:2009-2010学年正定中学高二下学期期末考试化学 题型:选择题
标准状况下,某同学向 100 mL H2S 饱和溶液中通入SO2, 所得溶液 pH 变化如图所示。下列分析中,正确的是( )

A.ab 段反应是:SO2 + 2 H2S=3S↓+2 H2O
B.亚硫酸是比氢硫酸更弱的酸
C.原H2S溶液的物质的量浓度为0.05 mol•L-1
D.b 点对应的溶液导电性最强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com