
| A. | 增大反应物的量,化学反应速率一定加快 | |
| B. | 气体反应体系的压强增大,化学反应速率一定加快 | |
| C. | 与金属锌反应时,硫酸的浓度越大,产生H2速率越快 | |
| D. | 2molX气体在2L的容器中反应,4s后浓度变为0.5mol•L-1,则其反应速率为0.125mol•L-1•s-1 |
分析 A.增加固体或纯液体,反应速率不变;
B.增大压强,如气体浓度不变,则反应速率不变;
C.如为浓硫酸,则不生成氢气;
D.根据v=$\frac{△c}{△t}$计算.
解答 解:A.增加固体或纯液体,则浓度不变,反应速率不变,故A错误;
B.增大压强,如气体浓度不变,则反应速率不变,如通入惰性气体,故B错误;
C.如为浓硫酸,则不生成氢气,故C错误;
D.v=$\frac{△c}{△t}$=$\frac{1mol/L-0.5mol/L}{4s}$=0.125mol•L-1•s-1,故D正确.
故选D.
点评 本题考查化学反应的计算以及影响因素的判断,为高频考点,侧重于学生的分析、计算能力的考查,注意把握反应速率的影响因素,难度不大.


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
 由短周期前10号元素组成的物质T和X,存在如图所示的转化关系.X不确定,易分解.下列有关说法正确的是( )
由短周期前10号元素组成的物质T和X,存在如图所示的转化关系.X不确定,易分解.下列有关说法正确的是( )| A. | 为使该转化成功进行,Y可以是酸性KMnO4溶液 | |
| B. | 等物质的量的T、X分子中含有π键的数目均为NA | |
| C. | T、X分子中的 原子分别采用sp2杂化和sp3杂化 原子分别采用sp2杂化和sp3杂化 | |
| D. | T分子中只含有极性键,X分子中既含有极性键又含有非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用Fe+CuSO4=Cu+FeSO4设计一个原电池.画出实验装置图. 并指出:
利用Fe+CuSO4=Cu+FeSO4设计一个原电池.画出实验装置图. 并指出:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Ba2+、Cl-、CO32- | B. | H+、Na+、Fe2+、MnO4- | ||
| C. | K+、AlO2-、Cl-、OH- | D. | K+、NH4+、OH-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1 | B. | 0.2mol•L-1 | C. | 0.5mol•L-1 | D. | 1mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
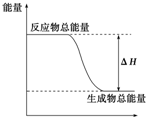
| A. | 铝热反应 | B. | 灼热的炭与二氧化碳反应 | ||
| C. | Ba(OH)2•8H2O晶体和NH4Cl晶体混合 | D. | 碳酸钙的分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,在B分子中Y原子的杂化方式为sp3,B中O-Y-H的键角小于(填“大于”“等于”或“小于”)A中O-Y-H键角.
,在B分子中Y原子的杂化方式为sp3,B中O-Y-H的键角小于(填“大于”“等于”或“小于”)A中O-Y-H键角.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷分子的球棍模型: | B. | NH4Cl的电子式: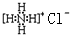 | ||
| C. | F原子的结构示意图: | D. | 中子数为20的氯原子${\;}_{17}^{37}$Cl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com