
【题目】合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料。从天然气获得合成气过程中可能发生的反应有:
①CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH1=206.1 kJ·mol-1
CO(g)+3H2(g) ΔH1=206.1 kJ·mol-1
②CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH2=247.3 kJ·mol-1
2CO(g)+2H2(g) ΔH2=247.3 kJ·mol-1
③CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3
请回答下列问题:
(1)在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示。反应进行的前5 min内,v(H2)= ;10 min时,改变的外界条件可能是 。
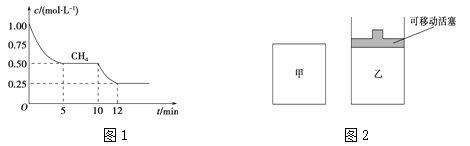
(2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等。在相同温度下发生反应②,并维持反应过程中温度不变。
①可以判断甲容器中反应已达平衡状态的是 。
a.生成CH4的速率是生成CO的速率的2倍
b.容器内压强保持不变
c.容器内气体的密度保持不变
d.容器内各气体的浓度保持不变
②甲乙两容器中反应达到平衡时,下列说法正确的是 。
a.化学反应速率:v (甲)>v (乙)
b.甲烷的转化率:α(甲)<α(乙)
c.压强:P(甲)= P (乙)
(3)反应③中ΔH3= kJ·mol-1。800 ℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
CO | H2O | CO2 | H2 |
0.5 mol | 8.5 mol | 2.0 mol | 2.0 mol |
此时反应③中正、逆反应速率的关系是 (填代号)。
a.v(正)>v(逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断
【答案】(1)0.3 mol·L-1·min-1 升高温度(或充入水蒸气)
(2)①bd
②ab
(3)-41.2;a
【解析】
试题分析:(1)根据图可知,前5min内甲烷的浓度由1.00mol/L减小为0.50mol/L,则v(CH4)= ![]() =0.1mol/(Lmin),由化学计量数之比等于反应速率之比,则v(H2)=3×0.1mol/(Lmin)=0.3mol/(Lmin),由图可知,10min时甲烷的浓度继续减小,且反应速率增大,该反应向正反应方向移动,而该反应为吸热反应,则升高温度符合题意,
=0.1mol/(Lmin),由化学计量数之比等于反应速率之比,则v(H2)=3×0.1mol/(Lmin)=0.3mol/(Lmin),由图可知,10min时甲烷的浓度继续减小,且反应速率增大,该反应向正反应方向移动,而该反应为吸热反应,则升高温度符合题意,
故答案为:0.3mol/(Lmin);升高温度;
(2)①a.由反应CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)可知,当生成CO的速率是生成CH4的速率的2倍时,可以判断甲容器中反应已达平衡状态,故a错误;b.该反应前后气体分子数不相等,所以容器内压强保持不变可以判断甲容器中反应已达平衡状态,故b正确;c.容器内气体的总质量不变、容器体积不变,则容器内气体的密度始终保持不变,故c错误;d.容器内各气体的浓度保持不变,可以判断甲容器中反应已达平衡状态,故d正确。
2CO(g)+2H2(g)可知,当生成CO的速率是生成CH4的速率的2倍时,可以判断甲容器中反应已达平衡状态,故a错误;b.该反应前后气体分子数不相等,所以容器内压强保持不变可以判断甲容器中反应已达平衡状态,故b正确;c.容器内气体的总质量不变、容器体积不变,则容器内气体的密度始终保持不变,故c错误;d.容器内各气体的浓度保持不变,可以判断甲容器中反应已达平衡状态,故d正确。
故答案为:bd;
②依据反应CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)可知,该反应是气体分子数增加的反应,所以达到平衡状态时压强:P(甲)>P (乙),化学反应速率:v (甲)>v (乙),甲烷的转化率:α(甲)<α(乙),所以ab正确,c错误。
2CO(g)+2H2(g)可知,该反应是气体分子数增加的反应,所以达到平衡状态时压强:P(甲)>P (乙),化学反应速率:v (甲)>v (乙),甲烷的转化率:α(甲)<α(乙),所以ab正确,c错误。
故答案为:ab;
(3)根据盖斯定律可知,①-②可得反应③,则△H3=+206.1kJ/mol-(+247.3kJ/mol)=-41.2kJ/mol,
800℃时,反应③的K=1.0时,正逆反应速率相等,化学平衡不移动;
由表格中的数据可知,气体的体积相同,则物质的量与浓度成正比,Q= ![]() <K=1.0,该反应向正反应方向移动,则正反应速率大于逆反应速率,即选a。
<K=1.0,该反应向正反应方向移动,则正反应速率大于逆反应速率,即选a。
故答案为:-41.2 kJ/mol;a。


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁的相互转化关系如图所示(部分反应物及反应条件已略去,箭头表示一步转化)。下列各组物质中,不能满足图示转化关系的是
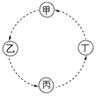
选项 | 甲 | 乙 | 丙 | 丁 |
A |
| CH2=CH2 | CH2BrCH2Br | CH2OHCH2OH |
B | NaAlO2 | Al(OH)3 | Al2O3 | Al |
C | CH3CH2OH | CH3CHO | CH3COOH | CH3COOC2H5 |
D | SiO2 | H2SiO3 | Na2SiO3 | Si |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质含有的化学键类型完全相同的是
A. HBr、CO2、NH3 B. Na2O、Na2O2、Na2S
C. NaCl、HCl、H2O D. NaOH、CaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学研究与工业生产中常常用到溶液中的反应。
(1)25℃时,0.05 mol·L-1Ba(OH)2溶液的pH= ,将该Ba(OH)2溶液与pH=2的HCl溶液混合,若所得混合溶液pH=7,则Ba(OH)2溶液与HCl溶液的体积比为 。
(2)CO2可转化成有机物实现碳循环:CO2![]() CH3OH
CH3OH![]() HCOOH……
HCOOH……
25 ℃时,几种酸的电离平衡常数如下:
化学式 | HCOOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-4 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
回答下列问题:
①用离子方程式表示HCOONa溶液呈碱性的原因 。
②物质的量浓度均为0.1 mol·L-1的下列四种物质:
a.Na2CO3 b.NaClO c.HCOONa d.NaHCO3 ,pH由大到小的顺序是 (填编号)。
(3)常温下,将0.2 mol·L-1的HCOOH和0.1 mol·L-1的NaOH溶液等体积混合,所得溶液的pH<7,说明所得混合溶液中HCOOH的电离程度 HCOONa的水解程度(填“大于”“等于”或“小于”)。
(4)含有Cr2O72-的废水毒性较大,某工厂废水中含5.00×10-3 mol·L-1的Cr2O72-。为使废水能达标排放,做如下处理:Cr2O72-![]() Cr3+、Fe3+
Cr3+、Fe3+![]() Cr(OH)3、Fe(OH)3。若处理后的废水中残留的c(Fe3+)=2×10-13 mol·L-1,则残留的Cr3+的浓度为 mol·L-1 (已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)。
Cr(OH)3、Fe(OH)3。若处理后的废水中残留的c(Fe3+)=2×10-13 mol·L-1,则残留的Cr3+的浓度为 mol·L-1 (已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出晶体Cu(NH3)4SO4·H2O。
(1)Cu2+基态核外电子排布式为 ;![]() 的空间构型为 。(用文字描述)
的空间构型为 。(用文字描述)
(2)乙醇分子中氧原子轨道杂化类型为 。与NH3互为等电子体的一种阳离子为 (填化学式)。
(3)1mol[Cu(NH3)4]2+中σ键的数目为 。
(4)某含有结晶水的铜的氯化物的晶胞结构如图所示,该化合物的化学式是 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】闪电时空气中有臭氧生成。下列说法正确的是
A. O3和O2互为同位素
B. O3与O2的相互转变是物理变化
C. 相同状况下,等体积O3和O2含有相同质子数
D. O3比O2氧化性更强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com