

分析 (1)若甲、乙、丙都是单质,甲、乙是同种气体,则丙为Al,甲、乙是氢气,Al与氢氧化钠反应生成偏铝酸钠和氢气;
(2)若甲是厨房某种液态调味品的主要成份,乙能使湿润的红色石蕊试纸变蓝,则甲为乙酸,乙为氨气,丙为醋酸铵;
(3)若甲、乙是同种有机物,体积分数为75%该有机物的水溶液常用于医疗消毒,有机物为乙醇,若丙中含有3个碳原子,则丙为甲酸乙酯,据此答题.
解答 解:(1)若甲、乙、丙都是单质,甲、乙是同种气体,则丙为Al,甲、乙是氢气,Al与氢氧化钠反应生成偏铝酸钠和氢气,反应的离子方程式为2Al+2 OH-+6H2O=2[Al(OH)4]-+3H2↑,
故答案为:2Al+2 OH-+6H2O=2[Al(OH)4]-+3H2↑;
(2)若甲是厨房某种液态调味品的主要成份,乙能使湿润的红色石蕊试纸变蓝,则甲为乙酸,乙为氨气,丙为醋酸铵,化学式为CH3COONH4,与丙中阳离子的质子数和电子数均相等的微粒是Na+、H3O+等,
故答案为:CH3COONH4;Na+、H3O+;
(3)若甲、乙是同种有机物,体积分数为75%该有机物的水溶液常用于医疗消毒,有机物为乙醇,若丙中含有3个碳原子,则丙为甲酸乙酯,结构简式为HCOOCH2CH3,
故答案为:HCOOCH2CH3.
点评 本题考查无机物的推断,属于开放性题目,丙与酸、碱反应为解答的突破口,再结合信息利用转化关系推断,题目难度中等.


科目:高中化学 来源: 题型:多选题
| t/s | 0 | 500 | 1000 | 1500 |
| n(X)/mol | 4.00 | 2.80 | 2.00 | 2.00 |
| A. | 平衡不移动 | |
| B. | 重新达到平衡后,再充入的M转化率小于50% | |
| C. | 重新达到平衡后,Y的平均反应速率与原平衡相等 | |
| D. | 重新达到平衡后,用X表示的v(正)比原平衡大 | |
| E. | 重新达到平衡后,混合气体中Y的体积分数增大 | |
| F. | 重新达到平衡后,M的物质的量浓度是原平衡的1.5倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 叠氮化物是一类重要化合物,氢叠氮酸(HN3)是一种弱酸,如图1为分子立体结构示意图.肼(N2H4)被亚硝酸氧化时便可生成氢叠氮酸(HN3):N2H4+HNO2═2H2O+HN3.它的酸性类似于醋酸,可微弱电离出H+和N${\;}_{3}^{-}$.试回答下列问题:
叠氮化物是一类重要化合物,氢叠氮酸(HN3)是一种弱酸,如图1为分子立体结构示意图.肼(N2H4)被亚硝酸氧化时便可生成氢叠氮酸(HN3):N2H4+HNO2═2H2O+HN3.它的酸性类似于醋酸,可微弱电离出H+和N${\;}_{3}^{-}$.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
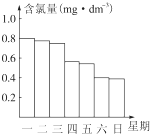 某校高一化学研究性学习小组对日常生活中的氯气用途进行了调查,了解到氯气可广泛地应用于衣物的漂白、水体的杀菌和消毒等.
某校高一化学研究性学习小组对日常生活中的氯气用途进行了调查,了解到氯气可广泛地应用于衣物的漂白、水体的杀菌和消毒等.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 | |
| 第一次称量 | 第二次称量 | ||
| 11.710g | 22.700g | 18.621g | a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol某气体的体积为22.4L,该气体所处的状态一定是标准状况 | |
| B. | 将22.4L氯化氢气体溶解于水并配成1L溶液,所得溶液浓度为1mol•L-1 | |
| C. | 任何状况下,1molCO2和18gH2O所含的分子数和原子数都相等 | |
| D. | 20ml0.1mol/L的AlCl3溶液中的Cl-的物质的量浓度小于50mL0.2mol/L的NaCl溶液中的Cl-的物质的量浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “胃舒平”是治疗胃酸过多的药物 | |
| B. | “阿司匹林”是解热镇痛和消炎的药物 | |
| C. | “创可贴”是小伤口的外用消炎药物 | |
| D. | “风油精”是包治百病的药物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com