
【题目】Cl2、ClO2等气体可作为水处理等方面有广泛应用的高效安全消毒剂.我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒.
(1)工业制漂白粉的化学方程式为 .
(2)消毒水时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,说明ClO2具有性.
(3)工业上在80℃时电解氯化钠溶液得到 NaClO3 , 然后与盐酸反应得到ClO2 . 电解时生成ClO3﹣的电极反应式为 .
(4)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8mg/L之间.碘量法可以检测水中ClO2的浓度,步骤如下:
Ⅰ.取一定体积的水样,加入一定量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝.
Ⅱ.加入一定量的Na2S2O3溶液.(已知:2S2O32﹣+I2═S4O62﹣+2I﹣)
Ⅲ.加硫酸调节水样pH至1~3.
操作时,不同pH环境中粒子种类如图所示: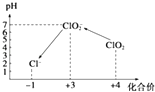
请回答:
①操作Ⅰ中反应的离子方程式是 .
②确定操作Ⅱ完全反应的现象是 .
③在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是 .
④若水样的体积为1.0L,在操作Ⅱ时消耗了1.0×10﹣3 mol/L的Na2S2O3溶液10mL,则水样中ClO2的浓度是mg/L.
【答案】
(1)2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O
(2)氧化
(3)Cl﹣+3H2O﹣6e﹣=ClO3﹣+6H+
(4)2ClO2+2I﹣=I2+2ClO2﹣;溶液蓝色褪去,且半分钟内不恢复原色;ClO2﹣+4I﹣+4H+=2I2+Cl﹣+2H2O;0.675
【解析】解:(1)利用氯气与消石灰反应制备漂白粉,反应生成氯化钙、次氯酸钙与水,反应方程式为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,所以答案是:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O;(2)反应中Fe、Mn元素化合价升高,被氧化,说明ClO2具有氧化性,
所以答案是:氧化性;(3)工业上在80℃时电解氯化钠溶液得到 NaClO3 , 氯离子发生氧化反应得到ClO3﹣ , 根据O元素守恒,可知有水参加反应,根据电荷守恒可知有氢离子生成,电极反应式为:Cl﹣+3H2O﹣6e﹣=ClO3﹣+6H+ ,
所以答案是:Cl﹣+3H2O﹣6e﹣=ClO3﹣+6H+;(4)①ClO2具有氧化性,加入淀粉后溶液变蓝,说明I﹣被氧化性I2 , 由图可知中性条件下生成ClO2﹣ , 反应离子方程式为:2ClO2+2I﹣=I2+2ClO2﹣ ,
所以答案是:2ClO2+2I﹣=I2+2ClO2﹣;②加入最后一滴Na2S2O3溶液时,溶液蓝色褪去,且半分钟内不恢复原色,说明滴定到终点,
所以答案是:溶液蓝色褪去,且半分钟内不恢复原色;③由图可知,酸性条件下ClO2﹣具有氧化性,将I﹣被氧化性I2 , 自身被还原为Cl﹣ , 反应离子方程式为:ClO2﹣+4I﹣+4H+=2I2+Cl﹣+2H2O,
所以答案是:ClO2﹣+4I﹣+4H+=2I2+Cl﹣+2H2O;④设1L水样中ClO2为xg,则:
2ClO2 | ~~ | I2 | ~~ | 2S2O32﹣ |
135g | 2mol | |||
xg | 1.0×10﹣3 mol/L×0.01mL |
所以135g:xg=2mol:1.0×10﹣3 mol/L×0.01mL
解答x=6.75×10﹣4
则水样中ClO2的浓度是0.675mg/L
所以答案是:0.675.


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述正确的是( )
A.已知2H2(g)+O2(g)=2H2O(g);△H=﹣483.6kJ/mol,则氢气的燃烧热为241.8kJ
B.已知4P(红磷,s)=P4(白磷,s);△H>0,则白磷比红磷稳定
C.含20.0g NaOH的稀溶液与稀硫酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(aq)+ ![]() H2SO4(aq)=
H2SO4(aq)= ![]() Na2SO4(aq)+H2O(l);△H=﹣57.4kJ/mol
Na2SO4(aq)+H2O(l);△H=﹣57.4kJ/mol
D.己知C(s)+O2 (g)=CO2(g);△H1? 2C(s)+O2(g)=2CO(g);△H2????? 则△H1>△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素R,其原子核外的电子层数为最外层电子数的一半,它可能形成常见的含氧酸根离子有:①R2O42-②RO42-③R2O32-④RO32-以下判断正确的是( )
A.若它能形成①时,则不可能形成③、④
B.若它能形成②时,则还可能形成①
C.若它能形成①时,则可能形成④
D.若它能形成②时,则还可能形成①、④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃的结构简式如图,下列说法不正确的是( ) 
A.1mol该烃完全燃烧消耗O211mol
B.与氢气完全加成后的产物中含2个甲基
C.1mol该烃完全加成消耗Br23mol
D.分子中一定共平面的碳原子有6个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种从植物中提取的天然化合物adamascone,可用于制作“香水”,其结构为: 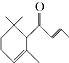 ,有关该化合物的下列说法不正确的是( )
,有关该化合物的下列说法不正确的是( )
A.分子式为C13H20O
B.该化合物可发生聚合反应
C.1 mol该化合物完全燃烧消耗19 mol O2
D.与溴的CCl4溶液反应生成的产物经水解、稀硝酸酸化后可用AgNO3溶液检验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】糖尿病是由于人体内胰岛素紊乱导致的代谢紊化综合症,以高血糖为主要标志.长期摄入高热量食品和缺少运动,都会导致糖尿病.
(1)血糖是指血液中的葡萄糖,下列有关说法正确的是
A.葡萄糖分子可表示为Ca(H2O)6 , 则每个葡萄糖分子含有6个H2O
B.葡萄糖与果糖互为同分异构体
C.糖尿病人尿糖较高,可用新制的氢氧化铜来检测病人尿液中的葡萄糖
D.淀粉水解的最终产物是氨基酸
(2)木糖醇 结构简式为:CH2OH(CHOH)3CH2OH是一种甜味剂,糖尿病人食用后不会导致血糖升高.若用氯原子取代木糖醇分子中碳原子上的氢原子,得到的一氯代物有 种同分异构体.
(3)糖尿病人不可饮酒,酒精在肝脏内可转化成有机物A.A的实验结果如下:
①通过实验测得A的相对分子质量为60.
②A由C、H、O三种元素组成,分子中只存在两种类型的氢原子,且这两种类型的氢原子的个数比为1:3.
③A可与酒精在一定条件下生成有芳香气味的物质.
请设计实验证明A与碳酸的酸性强弱:向A溶液中加入 溶液,发现有气泡冒出;写出A与酒精反应的化学方程式
(4)糖尿病人宜多吃蔬菜和豆类食品,豆类食品中富有蛋白质.下列说法正确的是
A.蛋白质溶液遇碘单质会变蓝色
B.蛋白质可以通过烧焦时的特殊气味鉴别
C.人体内不含水解纤维素的酶,不能消化纤维素,因此蔬菜中的纤维素对人体没有用处
D.部分蛋白质溶液遇浓硝酸变黄,称为蛋白质的显色反应
E.工业上常利用蛋白质的皂化反应来制取肥皂.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 在多电子的原子里,能量高的电子通常在离核近的区域内运动
B. 凡单原子形成的稳定离子,一定具有稀有气体元素原子的核外电子排布
C. 氯化氢属于共价化合物,溶于水能电离出H+、Cl—
D. 阴、阳离子通过静电引力而形成的化学键叫离子键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com