
【题目】已知:将Cl2通入适量NaOH溶液,产物中可能有NaCl、NaClO、NaClO3,且![]() 的值仅与温度高低有关,当n(NaOH)=6a mol时,下列有关说法正确的是
的值仅与温度高低有关,当n(NaOH)=6a mol时,下列有关说法正确的是
A. 改变温度,反应中转移电子的物质的量n的范围:3a mol≤n≤5a mol
B. 改变温度,产物中NaCl的最小理论产量为4a mol
C. 参加反应的氯气的物质的量为6a mol
D. 某温度下,若反应后![]() =6,则溶液中
=6,则溶液中![]()
【答案】A
【解析】
A.氧化产物只有NaClO3时,转移电子最多,氧化产物只有NaClO时,转移电子最少,根据电子转移守恒及钠离子守恒计算;B.反应中转移电子最少时生成NaCl最少;C.由Cl原子守恒可以知道:2n(Cl2)=n(NaCl)+n(NaClO)+n(NaClO3);由钠离子守恒可以知道: n(NaCl)+n(NaClO)+n(NaClO3)=n(NaOH);D.令n(ClO-)=1mol,反应后c(Cl-)/c(ClO-)=6,则n(Cl-)=6mol ,根据电子转移守恒计算n(ClO3-),据此计算判断。
A.氧化产物只有NaClO3时,转移电子最多,根据电子转移守恒n(NaCl)=5 n(NaClO3),由钠离子守恒: n(NaCl)+ n(NaClO3)=n(NaOH) ,故n(NaClO3)=1/6 n(NaOH)=1/6×6amol= a mol,转移电子最大物质的量=a×5=5a mol;氧化产物只有NaClO时,转移电子最少,根据电子转移守恒n(NaCl)= n(NaClO),由钠离子守恒: n(NaCl)+n(NaClO) = n(NaOH) ,故n(NaClO)=1/2n(NaOH)=3a mol,转移电子最小物质的量=3a×1=3a mol,故反应中转移电子的物质的量n的范围: 3a mol≤n≤5a mol,A正确;B.反应中还原产物只有NaCl,反应中转移电子最少时生成NaCl最少,根据电子转移守恒n(NaCl)= n(NaClO),由钠离子守恒: n(NaCl)+ n(NaClO) = n(NaOH) ,故n(NaClO)=1/2n(NaOH)=3amol,B错误;C.由Cl原子守恒可以知道, 2n(Cl2)=n(NaCl)+n(NaClO)+n(NaClO3),由钠离子守恒可以知道n(NaCl)+n(NaClO)+n(NaClO3)=n(NaOH),故参加反应的氯气的物质的量=1/2 n(NaOH)=3amol,C错误;D.令n(ClO-)=1mol,反应后c(Cl-)/c(ClO-)=6,则n(Cl-)=6mol,电子转移守恒,5×n(ClO3-)+1×n(ClO-)=1×n(Cl-),即5× n(ClO3-)+1=1×6,计算得出n(ClO3-)=1mol,则溶液中c(Cl-)/c(ClO3-)=6,D错误;正确选项A。


科目:高中化学 来源: 题型:
【题目】向仅含 Fe2+、I-、Br -的溶液通入适量氯气,溶液中这三种离子的物质的量的变化如下图所示。下列说 法中正确的是
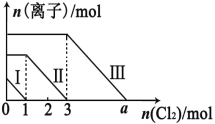
A. 线段Ⅲ代表 Fe2+的变化情况
B. 线段Ⅰ代表 Br -的变化情况
C. 原混合溶液中 n(FeBr2)=4mol
D. a 数值等于 6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA是阿伏加德罗常数的数值。下列两种说法均不正确的是( )
A. 用惰性电极电解CuSO4溶液后,如果加入0.1molCu(OH)2能使溶液复原,则电路中转移电子的数目为0.2NA;将78gNa2O2与过量CO2反应转移的电子数为2NA
B. 在标况下,22.4LSO3和22.4LC2H4原子个数比为2:3;42克由C2H4和C5H10组成的混合气体中含共用电子对数目为9NA个
C. 25℃时,50g98%浓硫酸和50g 98%浓磷酸混合后含氧原子数为4NA;含0.2molH2SO4的浓硫酸与足量铜充分反应,生成SO2分子的数目少于0.1NA
D. 12g石墨烯(单层石墨)中含有六元环的个数为NA;1mol的羟基与1mol的氢氧根离子所含电子数均为9NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅的说法不正确的是( )
A. 硅是非金属元素,但它的单质是灰黑色有金属光泽的固体
B. 硅的导电性能介于导体和绝缘体之间,是良好的半导体材料
C. 硅的化学性质不活泼,常温下不与任何物质起反应
D. 当加热到一定温度时,硅能与氯气、氢气等非金属反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列各题:
(1)已知FeCl3的沸点:319℃,熔点:306℃,则FeCl3的晶体类型为___________。P形成的三种酸的酸性由强到弱的顺序为:HPO3>H3PO4>H3PO3,原因是___________________。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2,T的基态原子价电子排布式为___________________,Q2+的未成对电子数是______________。
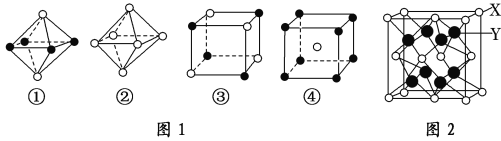
(3)如图1是从NaCl或CsCl晶体结构图中分割出来的部分结构图,判断NaCl晶体结构的图是图1中的______________。
(4)[Cu(NH3)4]2+配离子中存在的化学键类型有_____________(填序号)。
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
(5)若[Cu(NH3)4]2+具有对称的空间构型,且当[Cu(NH3)4]2+中的两个NH3被两个Cl-取代时,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为______________(填序号)
①平面正方形 ②正四面体 ③三角锥形 ④V形
(6)X与Y可形成离子化合物,其晶胞结构如图2所示,其中X和Y的相对原子质量分别为a和b,NA表示阿伏加德罗常数,晶体密度为ρg/cm3,则晶胞中距离最近的X、Y之间的核间距离是_____________pm(用含ρ、a、b、NA的代数式表达)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素A、B、C、D、E、F的原子序数依次增大。A、E元素的原子最外层均只有一个电子,且A和E可形成离子化合物;B是组成有机化合物的核心元素;C的单质是空气中含量最多的气体;D原子的最外层电子数是其内层电子数的3倍;F和D同主族。请回答:
(1)A、D、E组成的化合物的电子式为_____。
(2)B元素在周期表中的位置是__,由它组成的一种同素异形体属于原子晶体,其名称为___。
(3)C、D的简单氢化物中热稳定性较强的物质的化学式为____。
(4)E、F的最高价氧化物对应的水化物之间反应的离子方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“结晶玫瑰”是具有强烈玫瑰香气的结晶型固体香料,在香料和日用化工产品中具有广阔的应用价值。其化学名称为“乙酸三氯甲基苯甲酯”,目前国内工业上主要使用以下路径来合成结晶玫瑰:
I.由苯甲醛和氯仿合成三氯甲基苯基甲醇。
Ⅱ.三氯甲基苯基甲醇与乙酸酐发生乙酰化反应制得“结晶政瑰”。

已知:
三氯甲基苯基甲醇 | 相对分子质量:225.5。无色液体。不溶于水,密度比水大,溶于乙醇 |
乙酸酐 | 无色液体。与水反应生成乙酸,溶于乙醇 |
“结晶玫瑰” | 相对分子质量:267.5。白色晶体。熔点:88℃。不溶于水,溶于乙醇 |
具体实验步骤如下:
I.由苯甲醛和氯仿合成三氯甲基苯基甲醇。
步骤一:装置如图所示。依次将苯甲醛、氯仿加入三颈烧瓶中,仪器A中加入KOH和助溶剂。滴加A中试剂并搅拌,开始反应并控制在一定温度下进行。

步骤二:反应结束后,将混合物依次用5%的盐酸、蒸馏水洗涤。
步骤三:将洗涤后的混合物蒸馏,除去其他有机杂质,加无水琉酸镁,过滤。滤液即为粗制三氯甲基萃基甲醇。
Ⅱ.三氯甲基苯基甲醇与乙酸酐发生乙酰化反应制得“结晶玫瑰”。
步骤四:向另一三颈瓶中加入制备的三氯甲基苯基甲醇、乙酸酐,并加入少量浓硫酸催化反应,加热控制反应温度在90℃~110℃之间。
步骤五:反应完毕后,将反应液倒入冰水中,冷却结晶获得“结晶玫瑰”。
请回答下列问题:
(1)仪器A的名称是_________。实验装置B中,冷凝水应从_____口进(填“a”或“b”)。
(2)步骤二中,用5%的盐酸洗涤的主要目的是___________。在洗涤、分液操作中,应充分振荡,然后静置,待分层后有机层应___________ (填序号)。
A.直接从上口倒出
B.先将水层从上口倒出,再将有机层从下口放出
C.直接从下口放出
D.先将水层从下口放出,再将有机层从下口放出
(3)步骤三中,加入无水硫酸镁的目的是___________。若未加入无水硫酸镁,直接将蒸馏所得物质进行后续反应,会使“结晶玫瑰”的产率偏______(填“高”或“低”),其原因是___________ (利用平衡移动原理解释)。(已知Ⅱ的具体反应如图所示)

(4)步骤四中,加料时,应先加入三氯甲基苯基甲醇和乙酸酐,然后慢慢加入浓硫酸并搅拌,主要是为了__________。加热反应时,为较好的控制温度,最适宜的加热方式为_____(填“水浴加热”或“油浴加热”)。
(5)22.55g三氟甲基苯基甲醇与足量乙酸酐充分反应得到结晶玫瑰21.40g,则产率是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com