
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3401 |
科目:高中化学 来源:不详 题型:单选题
| A.4, 3, 1, 2 | B.3, 3, 2, 2 | C.4, 2, 2, 2 | D.2, 3, 3, 2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.具有规则几何外形的固体一定是晶体 |
| B.晶体与非晶体的根本区别在于是否具有规则的几何外形 |
| C.具有各向异性的固体一定是晶体 |
| D.粉末状的物质不是晶体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 晶体类型 | | | | |
| 各组中物质的编号 | | | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
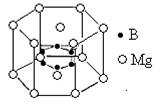
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
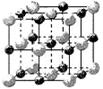
 周期表中前36号的元素,其原子序数依次增大。A与其他4种元素既不在同一周期又不在同一族。B和C属同一主族,D和E属同一周
周期表中前36号的元素,其原子序数依次增大。A与其他4种元素既不在同一周期又不在同一族。B和C属同一主族,D和E属同一周 期,又知E是周期表中1—18列中的第8列元素。D的原子序数比E小6,D跟B可形成
期,又知E是周期表中1—18列中的第8列元素。D的原子序数比E小6,D跟B可形成 离子化合物其晶胞结构如图。
离子化合物其晶胞结构如图。
 请回答:
请回答: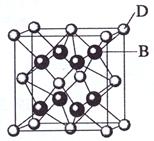
 (1)
(1) 画出A的原子结构示意图 ;
画出A的原子结构示意图 ; E的+2价离子的电子排布式为
E的+2价离子的电子排布式为  ;
; 写出C的单质与水反应的离子方程式 ;
写出C的单质与水反应的离子方程式 ; 别该离子化合物是否为晶体,最可靠的科学方法是 ,该离子化合物晶体的密度为ag·cm-3,B、D两元素的相
别该离子化合物是否为晶体,最可靠的科学方法是 ,该离子化合物晶体的密度为ag·cm-3,B、D两元素的相 对原子质量分别为b、c,则晶胞的体积是 cm3(只要求列出算式)。
对原子质量分别为b、c,则晶胞的体积是 cm3(只要求列出算式)。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.离子晶体中每个离子周围均吸引着6个带相反电荷的离子 |
| B.金属导电的原因是在外电场作用下金属产生自由电子,电子定向运动 |
| C.分子晶体的熔点很低,常温下都呈液态或气态 |
| D.原子晶体中各相邻原子都以共价键结合 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com