
| A. | 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-389.9kJ•mol-1 | |
| B. | 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=+2599.2kJ•mol-1 | |
| C. | C2H2(g)+$\frac{5}{2}$O2(g)═2CO2(g)+H2O(l)△H=-1299.6kJ•mol-1 | |
| D. | 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-1299.6kJ•mol-1 |
分析 已知燃烧7.8g乙炔物质的量为:$\frac{7.8g}{26g/mol}$=0.3mol,反应生成二氧化碳气体和液态水时,放出389.9kJ热量,1mol乙炔完全燃烧生成二氧化碳和液体水放热1299.6KJ,标注物质的聚集状态和对应反应的焓变写出.
解答 解:已知燃烧7.8g乙炔物质的量为:$\frac{7.8g}{26g/mol}$=0.3mol,反应生成二氧化碳气体和液态水时,放出389.9kJ热量,
则1mol乙炔完全燃烧生成二氧化碳和液体水放出热量为:389.9kJ×$\frac{1mol}{0.3mol}$=1299.6KJ,
所以该反应的热化学方程式为:C2H2(g)+2.5O2(g)═2CO2(g)+H2O(l)△H═-1299.6kJ•mol-1,
故选C.
点评 本题考查了热化学方程式书写,题目难度不大,明确热化学方程式的书写原则为解答关键,注意热化学方程式中必须标明物质的聚集状态.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14.6g | B. | 7.3g | C. | 3.65g | D. | 0.73g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验过程 | 预期现象 | 实际观察到的现象 |
| a.取已切去表皮的一小块金属钠,放入盛有水的烧杯中 | 立即剧烈反应 | 开始时钠块浮在水面上不反应,稍后才开始与水剧烈反应 |
| b.向盛有适量水(内含2滴酚酞)的试管中加入一小段镁条 | 有气泡产生,溶液变红色 | 没有相应现象,加热后仍无明显变化 |
| c.向两支盛有3mL 2mol•L-1硫酸的试管中加入大小相同的镁条和铝片 | 镁、铝与硫酸反应产生气泡剧烈程度不同 | 镁与硫酸反应产生气泡速率较快 |
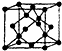
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大.X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题:
X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大.X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作及现象 | 实验结论 |
| A | 蔗糖溶液中加入稀硫酸共热,冷却后加入银氨溶液,水浴加热,无银镜产生 | 蔗糖未发生水解 |
| B | 乙醇中加入浓硫酸共热,产生的气体通入溴水,溴水褪色 | 气体为纯净的乙烯 |
| C | 鸡蛋白溶液中分别加入饱和(NH4)2SO4溶液和HgCl2溶液均有白色沉淀 | 蛋白质均发生了盐析 |
| D | 微热含有酚酞的NaHCO3溶液,溶液红色加深 | 盐类水解反应为吸热反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用饱和的Na2SO4溶液使鸡蛋清发生盐析,进而分离、提纯蛋白质 | |
| B. | 淀粉和纤维素的组成都可用(C6H10O5)n表示,它们互为同分异构体 | |
| C. | 苯酚与苯甲酸都能发生加成反应和取代反应 | |
| D. | 汽油和植物油都是碳氢化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,7.8g固体Na2O2中,含有的阴阳离子总数为0.4NA | |
| B. | 常温常压下,17g烃基含有的电子总数为9N | |
| C. | 标准状况下,11.2LCH2CI2中含有的共价键数目为2N. | |
| D. | CH2=CH2和CH2=CHCH3的混合气体28g,完全燃烧后生成的CO2分子数目为2.5N |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com