
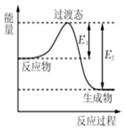
 如图为1molSO2Cl2(g)和1molSCl2(g)反应生成SOCl2(g)能量变化的示意图,已知E1=xkJ/mol,E2=ykJ/mol,下列有关说法正确的是( )
如图为1molSO2Cl2(g)和1molSCl2(g)反应生成SOCl2(g)能量变化的示意图,已知E1=xkJ/mol,E2=ykJ/mol,下列有关说法正确的是( )| A. | 若在反应体系中加入催化剂,E1不变 | |
| B. | 活化能的大小决定了反应热的大小 | |
| C. | 该反应的活化能等于ykJ/mol | |
| D. | 1molSO2Cl2(g)和1molSCl2(g)反应生成SOCl2(g)的△H=(x-y)kJ/mol |
分析 由图可知,该反应中反应物总能量大于生成物总能量,为放热反应,焓变等于正逆反应的活化能之差,以此来解答.
解答 解:A.若在反应体系中加入催化剂,降低反应所需的活化能,则E1减小,故A错误;
B.正逆反应的活化能的大小决定了反应热的大小,故B错误;
C.由图可知,该反应的活化能等于xkJ/mol,故C错误;
D.焓变等于正逆反应的活化能之差,则1molSO2Cl2(g)和1molSCl2(g)反应生成SOCl2(g)的△H=(x-y)kJ/mol,故D正确;
故选D.
点评 本题考查反应热与焓变,为高频考点,把握反应中能量变化、焓变与活化能的关系为解答的关键,侧重分析与应用能力的考查,注意选项B为易错点,题目难度不大.


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 日常生活中常用95%的乙醇溶液来杀菌消毒,其实就是使蛋白质变性 | |
| B. | 可用淀粉溶液来检测食盐中是否含碘 | |
| C. | 误食重金属盐引起人体中毒,可喝牛奶或豆浆解毒 | |
| D. | 人应该多吃蔬菜,因为蔬菜中纤维素在人体内可水解为葡萄糖,为人提供营养 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 改用锌粉 | B. | 滴入几滴硫酸铜溶液 | ||
| C. | 加入少量1mol•L-1稀硫酸 | D. | 加入少量NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q与Y组成的常见物质是一种两性物质,能与氨水反应 | |
| B. | 已知WRZQ3溶液呈酸性,若将WRZQ3固体溶于水,能促进水的电离 | |
| C. | 元素Q与W形成的两种常见化合物中含有相同比例的阴、阳离子 | |
| D. | 元素T、Q、W、Y的原子半径大小为T<Q<Y<W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用碱式滴定管量取10.15 mL KMnO4溶液 | |
| B. | 在FeBr3溶液中通入Cl2以除去其中FeCl2杂质 | |
| C. | 用FeCl3溶液检验KC1中是否含有KSCN杂质 | |
| D. | 常温下将铝片和铜片分别放入浓硝酸中以证明铝比铜活泼 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
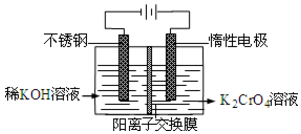 以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下:下列说法不正确的是( )
以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下:下列说法不正确的是( )| A. | 在阴极式,发生的电极反应为:2H2O+2e-=2OH-+H2↑ | |
| B. | 在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2CrO42-+2H+?Cr2O72-+H2O向右移动 | |
| C. | 该制备过程总反应的化学方程式为:4K2CrO4+4H2O$\frac{\underline{\;通电\;}}{\;}$2K2Cr2O7+4KOH+2H2↑+2O2↑ | |
| D. | 测定阳极液中K和Cr的含量,若K与Cr的物质的量之比为d,则此时铬酸钾的转化率为α=$\frac{d}{2}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
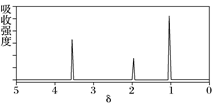
| A. | 若A的分子式为C3H6O2,则其结构简式为CH3COOCH3 | |
| B. | 由核磁共振氢谱可知,该有机物分子中有三种不同化学环境的氢原子,且个数之比为1:2:3 | |
| C. | 仅由其核磁共振氢谱无法得知其分子中的氢原子总数 | |
| D. | 若A的化学式为C3H6O2,则其同分异构体有三种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com