
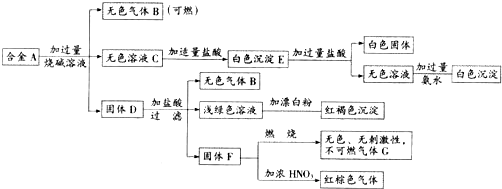
 ,故答案为:
,故答案为: ;
;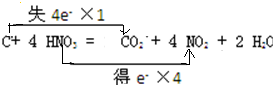 ,
,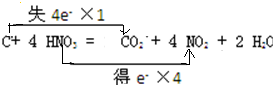 .
.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
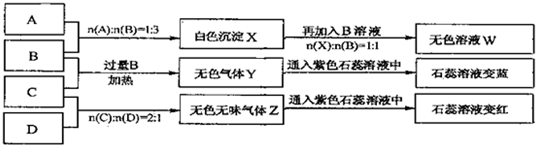
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、O2- 1s22s22p4 |
| B、Ca[Ar]3d2 |
| C、Si 1s22s22p63s23p2 |
| D、Zn[Ar]3d104s1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、s电子绕核旋转,其轨道为一圆圈,而p电子是∞字形 |
| B、能层为1时,有自旋相反的两个轨道 |
| C、能层为3时,有3s、3p、3d、4f四个轨道 |
| D、s电子云是球形对称的,其疏密程度表示电子在该处出现的几率大小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、处于最低能量的原子叫做基态原子 |
| B、4f 4表示4f能级有四个轨道 |
| C、同一原子中,2p、3d、4f能级的轨道数依次增多 |
| D、同一原子中,2p、3p、4p电子的能量逐渐增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
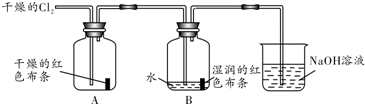
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com