
| A. | 陶瓷 | B. | 水泥 | C. | 玻璃 | D. | 光导纤维 |
科目:高中化学 来源: 题型:解答题
| t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
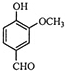
| A. | A的分子式是C8H10O3 | B. | A分子中含有酯基 | ||
| C. | A只能发生取代反应 | D. | A能与Na反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 应称量NaOH的质量/g | 应选用容量瓶的规格/mL | 除容量瓶外还需要的其它仪器 |
| 4.0 | 500 | 烧杯、量筒、玻璃棒、药匙、托盘天平、胶头滴管 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制5% NaCl溶液时,将已准确称量的NaCl放入烧杯中并加适量的水搅拌溶解 | |
| B. | 配制1mol•L-1 Na0H溶液时,将溶解后的NaOH溶液立即注入容量瓶 | |
| C. | 配制0.1mol•L-1的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释 | |
| D. | 配制1mol•L-1 Na2CO3溶液500mL,将Na2CO3放在托盘天平右盘称量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 步 骤 | 现 象 |
| Ⅰ.将NaCl溶液与AgNO3溶液混合 | 产生白色沉淀 |
| Ⅱ.向所得固液混合物中加Na2S溶液 | 沉淀变为黑色 |
| Ⅲ.将Ⅱ中经过滤洗得到的黑色沉淀分成两份,在一份沉淀中加蒸馏水,另一份沉淀中加入NaCl溶液,同时浸泡较长时间. | 加蒸馏水的沉淀仍为黑色,加入NaCl溶液的沉淀变为乳白色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com