
| A. | Na2O2是碱性氧化物 | |
| B. | Na2O2中阴阳离子个数比为1:1 | |
| C. | 可用澄清石灰水来区分Na2CO3 和NaHCO3 | |
| D. | 与同浓度盐酸反应的剧烈程度:NaHCO3>Na2CO3 |
分析 A.过氧化钠与酸反应生成盐和气体;
B.过氧化钠中阳离子为钠离子,阴离子为过氧根离子;
C.Na2CO3 和NaHCO3均与石灰水反应生成白色沉淀;
D.碳酸氢钠与盐酸反应快.
解答 解:A.过氧化钠与酸反应生成盐和气体,则不是碱性氧化物,故A错误;
B.过氧化钠中阳离子为钠离子,阴离子为过氧根离子,则Na2O2中阴阳离子个数比为2:1,故B错误;
C.Na2CO3 和NaHCO3均与石灰水反应生成白色沉淀,现象相同,不能鉴别,故C错误;
D.碳酸钠与盐酸反应分步进行,则与同浓度盐酸反应的剧烈程度:NaHCO3>Na2CO3,故D正确;
故选D.
点评 本题考查物质的鉴别和检验,为高频考点,把握物质的性质、性质差异及发生的反应为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
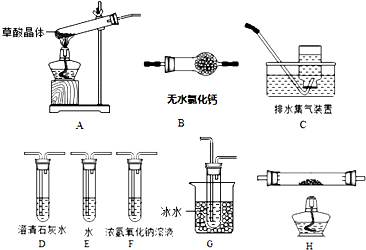
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Na+ H+ Ba2+ |
| 阴离子 | OH- CO32- SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
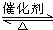 N2+4NH3;为抑制肼的分解,可采取的合理措施有降低反应温度(任写一种).
N2+4NH3;为抑制肼的分解,可采取的合理措施有降低反应温度(任写一种).
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
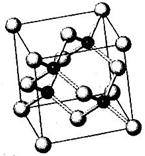 N、P、As、Ga、Cr等元素化合物种类繁多,具有重要的研究价值和应用价值.请回答下列问题:
N、P、As、Ga、Cr等元素化合物种类繁多,具有重要的研究价值和应用价值.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
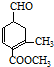 )、乙(
)、乙(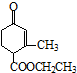 )两种有机物,下列说法中不正确的是( )
)两种有机物,下列说法中不正确的是( )| A. | 可用新制的氢氧化铜悬浊液区分这两种有机物 | |
| B. | 1 mol甲与H2在一定条件下反应,最多消耗3 mol H2 | |
| C. | 甲、乙互为同分异构体 | |
| D. | 等物质的量的甲、乙分别与足量NaOH溶液反应消耗NaOH的量相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com