
【题目】氯碱厂电解饱和氯化钠溶液制取氢氧化钠的工艺流程:
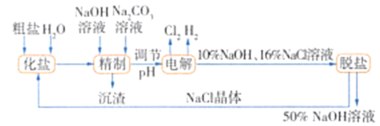
依据图中所给信息,完成下列填空:
(1)电解时发生反应的化学方程式为________________。
(2)粗盐含Ca2+、Mg2+等杂质,加入NaOH溶液、Na2CO3溶液的目的就是除去这些杂质,但如果精制时发现其中SO42-含量也较高,必须添加含钡离子的试剂除去SO42-,该试剂可以是________(填序号)。
a. Ba(OH)2溶液 b.Ba(NO3)2溶液 c.BaCl2溶液
(3)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为________(填序号)。
a.先加NaOH溶液,后加Na2CO3溶液,再加钡试剂
b.先加NaOH溶液,后加钡试剂,再加Na2CO3溶液
c.先加钡试剂,后加NaOH溶液,再加Na2CO3溶液
【答案】![]() ac bc
ac bc
【解析】
(1)根据反应物和生成物写出反应方程式;
(2)除杂试剂要求不引入新的杂质;
(3)有效除去Ca2+、Mg2+、SO42-,应注意碳酸钠在氯化钡之后。
(1)电解后产生氢气、氯气和氢氧化钠,则方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
(2)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂选择的原则是不引入难以除去的杂质离子;
a.Ba(OH)2 ,加入过量试剂可以除去硫酸根离子,过量氢氧根离子在最后加盐酸除去,故a符合;
b.Ba(NO3)2,加入过量试剂,硝酸根离子不能除去,引入杂质离子硝酸根,故b不符合;
c.BaCl2,加入过量试剂硫酸根离子全部沉淀,氯离子不是杂质离子,故c符合;
故选ac;
(3)有效除去Ca2+、Mg2+、SO42-,应注意碳酸钠在钡试剂之后,是为除去过量的钡离子,显然选项bc符合,故答案为:bc。


科目:高中化学 来源: 题型:
【题目】将两份质量均为mg的铝片分别置于盛有盐酸、NaOH溶液的两个烧杯中,待反应结束后,测得两个烧杯中溶液的质量均增加了![]() ,下列有关说法中错误的是
,下列有关说法中错误的是
A.![]()
B.两个烧杯中发生的反应所转移的电子数均为0.3NA
C.两个烧杯中消耗的溶质的物质的量之比为![]()
D.两个烧杯中生成的氢气的体积均为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油裂化和裂解过程得到的CH2=CH2,在一定条件下可以聚合成高分子化合物。含有 结构的化合物与CH2=CH2一样,可以在一定条件下聚合成高分子化合物。
结构的化合物与CH2=CH2一样,可以在一定条件下聚合成高分子化合物。
(1)广泛用作农用薄膜的聚氯乙烯塑料,是由CH2=CHCl在催化剂、加热的条件下聚合成的,其化学方程式是________________。
(2)电器包装中大量使用的泡沫塑料的主要成分是聚苯乙烯( ),它是由________________(写结构简式)聚合而成的。
),它是由________________(写结构简式)聚合而成的。
(3)CH2=CHCl与聚苯乙烯的单体在一定条件下可发生加聚反应,所得产物的结构简式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由 N2O 和 NO 反应生成 N2 和 NO2 的能量变化如图所示。下列说法不正确的是

A.反应生成 1 mol N2 时转移 2 mol e-
B.反应物能量之和大于生成物能量之和
C.N2O(g)+NO(g)=N2(g)+NO2(g) ΔH=-139 kJ·mol-1
D.断键吸收能量之和大于成键释放能量之和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用KSCN溶液和![]() 溶液探究
溶液探究![]() 的还原性时出现异常现象,实验如下:
的还原性时出现异常现象,实验如下:
|
|
|
|
|
|
溶液变红,大约10秒左右红色褪去,有气体生成 | 溶液变红且不褪色,有气体生成 | 溶液变红且不褪色,滴加盐酸和 |
下列说法不正确的是
A.对比![]() ,可以判定酸性条件下
,可以判定酸性条件下![]() 可以氧化
可以氧化![]()
B.实验![]() 中发生的氧化还原反应有两种
中发生的氧化还原反应有两种
C.![]() 中红色溶液中含有
中红色溶液中含有![]() 胶体
胶体
D.![]() 中发生的氧化还原反应为:
中发生的氧化还原反应为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图, 水槽中试管内有一枚铁钉,放置数天观察:

(1)若液面上升,则溶液呈______性,发生______腐蚀,电极反应式为:负极:______________,正极:___________________。
(2)若液面下降,则溶液呈________性,发生_________腐蚀,电极反应式为:负极:______________;正极:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中可提取多种化工原料,下图是工业上对海水资源进行综合利用的流程图。试回答下列问题:
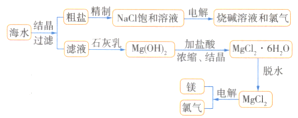
(1)若粗盐中含有杂质离子Ca2+、Mg2+、SO42-,精制时所用试剂为A.盐酸、B.BaCl2溶液、C.NaOH溶液、D.Na2CO3溶液。则加入试剂的顺序是________(填序号)。
(2)写出用海滩上的贝壳制Ca(OH)2的化学方程式:________________。
(3)电解熔融MgCl2可制取镁和Cl2,其中Cl2和Ca(OH)2反应可制得漂白粉。制漂白粉的化学方程式为________________。
(4)从经济效益角度考虑,该化工厂厂址应选在________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。下列方法中,可以使醋酸溶液中CH3COOH电离程度增大的是_______。
A. 滴加少量浓盐酸 B. 微热溶液 C. 加水稀释 D. 加入少量醋酸钠晶体
(2)用0.1mol·L-1NaOH溶液分别滴定体积均为 20mL、浓度均为0.1mol·L-1的盐酸和醋酸溶液, 得到滴定过程中溶液 pH 随加入 NaOH 溶液体积而变化的两条滴定曲线。

①滴定醋酸的曲线是_______(填“I”或“II”)。
②图I中 V=10 时,溶液中的c(Na+)________c(A-)。(填“>”、“=”或“<”,其中A-代表酸根离子)
(3)下表为某同学所测 25℃时,甲、乙两种溶液的 pH。
甲 | 乙 | |
pH | 11 | 11 |
溶液 | 氨水 | 氢氧化钠溶液 |
①甲溶液中的c(OH-) =_________mol/L。
②25℃时,等体积的甲、乙两溶液与等浓度的盐酸恰好完全反应,消耗的盐酸体积:甲_______乙。(填“>”、“=”或“<”)
③甲、乙溶液均加水稀释 10 倍后,所得溶液的 pH:甲______乙。(填“>”、“=”或“<”)
(4)下表是几种常见弱酸的电离常数
化学式 | CH3COOH | H2SO3 | HClO | H2CO3 |
电离常数 | 1.8×10-5 | K1=1.23×10-2 K2=6.6×10-8 | 3.0×10-8 | K1=4.4×10-7 K2=4.7×10-11 |
以下反应对应的离子方程式正确的是_______。
A.Na2CO3溶液吸收少量SO2:![]() +SO2+H2
+SO2+H2![]() +
+![]()
B.漂白液生效的原理:ClO-+CO2+H2O = HClO+![]()
C.次氯酸钠溶液吸收少量SO2:ClO-+SO2+H2O = HClO+![]()
D.醋酸除水垢中的CaCO3:2CH3COOH+CaCO3= Ca2++2CH3COO-+H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,①和②为两个体积相同的固定容器,图中“![]() ”和“
”和“![]() ”分别表示氢原子和氧原子,则下列说法正确的是( )
”分别表示氢原子和氧原子,则下列说法正确的是( )
①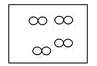 ②
②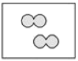
A.若①中的![]() 为4mol,则②中所含原子总数为
为4mol,则②中所含原子总数为![]() 个
个
B.①和②中气体的质量之比为1:8
C.![]() 、
、![]() 均能发生化合反应,但均不能发生置换反应
均能发生化合反应,但均不能发生置换反应
D.两容器的温度和压强均相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com