
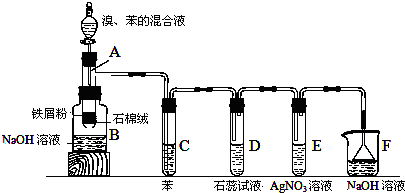
 .
.分析 (1)苯和液溴在Fe作催化剂条件下能发生取代反应生成溴苯与HBr;
(2)溴易挥发,易溶液有机溶剂,用苯溶解溴,防止对D、E装置中反应干扰;该反应中有溴化氢生成,溴化氢溶于水得到氢溴酸,氢溴酸能使石蕊试液变红色;氢溴酸能和硝酸银反应生成淡黄色AgBr沉淀;
(3)F进行尾气处理,吸收HBr;
(4)HBr易溶于水,直接将导管伸入水溶液液面以下,会发生倒吸;
(5)制备的溴苯中含有溴、溴化铁、苯等杂质,先用水洗去可溶性杂质,再用氢氧化钠溶液除去溴,通过分液方法分离,再用干燥剂干燥有机物溶液,最后蒸馏分离得到溴苯与苯.
解答 解:(1)苯和液溴在Fe作催化剂条件下能发生取代反应生成溴苯与HBr,反应方程式为: ,
,
故答案为:催化剂; ;
;
(2)溴易挥发,易溶液有机溶剂,用苯吸收Br2蒸气,防止对D、E装置中反应的干扰;该反应中有溴化氢生成,能与水蒸气结合成氢溴酸液滴,液面上有白雾,溴化氢溶于水得到氢溴酸,氢溴酸是酸性物质,能使石蕊试液变红色,氢溴酸能和硝酸银反应生成淡黄色AgBr沉淀;
故答案为:吸收Br2蒸气;D、E液面上有白雾,D管中石蕊试液变红,E中有淡黄色沉淀生成;
(3)F进行尾气处理,吸收HBr,反应离子方程式为:H++OH-=H2O,故答案为:H++OH-=H2O;
(4)HBr易溶于水,直接将导管伸入水溶液液面以下,会发生倒吸,装置D、E中导管口在液面上方,能防止倒吸,F中倒置漏斗增大了气体与氢氧化钠溶液的接触面积,有缓冲作用,能够防止倒吸,
故答案为:DEF;
(5)制备的溴苯中含有溴、溴化铁、苯等杂质,先用水洗去可溶性杂质,再用氢氧化钠溶液除去溴,通过分液方法分离,再用干燥剂干燥有机物溶液,最后蒸馏分离得到溴苯与苯,正确的操作顺序是:②④⑤③①;
故答案为:B.
点评 本题考查有机物实验制备,涉及溴苯的制取,侧重考查学生对装置与原理的分析评价,明确各个装置的作用及基本操作方法,难度不大.


科目:高中化学 来源: 题型:选择题
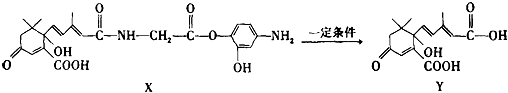
| A. | X可以发生氧化、取代、酯化、加聚、缩聚反应,并能与盐酸反应生成有机盐 | |
| B. | Y既可以与FeCl3溶液发生显色反应,又可使酸性KMnO4溶液褪色 | |
| C. | 1mol X与足量NaOH溶液反应,最多消耗4mol NaOH | |
| D. | X结构中有2个手性碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
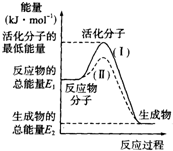 (1)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需要提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察下图,然后回答问题.
(1)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需要提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察下图,然后回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HSO3溶于少量的NaOH溶液中:HSO3-+OH-═SO32-+H2O | |
| B. | 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| C. | 硫化亚铁溶于稀硝酸中:FeS+2H+═Fe2++H2S↑ | |
| D. | 在NaHSO4溶液中滴加Ba(OH)2至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 给试管中的铜与浓硫酸加热,发现试管底部有白色固体并夹杂有少量黑色物质,此白色固体为硫酸铜,黑色固体为氧化铜 | |
| B. | 浓硝酸在光照条件下变黄,说明浓硝酸不稳定,生成的有色产物能溶于浓硝酸 | |
| C. | 相同质量的铜分别与足量的等体积的浓硝酸和稀硝酸反应,生成溶液分别为绿色和蓝色,是由于反应时产生的铜离子浓度前者大于在后者 | |
| D. | 将铜片放入浓硫酸中,无明显实验现象,说明铜在冷的浓硫酸中发生钝化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (CH3)2C(Cl)CH2CH3的名称为:2-氯-2-甲基丁烷 | |
| B. | 某烷烃主链4个碳原子数的同分异构体有2种,则与其碳原子个数相同的且主链4个碳原子的单烯烃有4种 | |
| C. | 1mol有机物(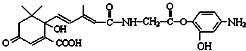 )与NaOH溶液反应,最多消耗5mol NaOH )与NaOH溶液反应,最多消耗5mol NaOH | |
| D. | 1 mol β-紫罗兰酮 ( 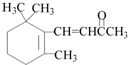 )与1 mol Br2发生加成反应可得到2种不同产物 )与1 mol Br2发生加成反应可得到2种不同产物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com