
某化学实验小组为确定过氧化氢分解的最佳催化条件,用如图装置进行实验,反应物用量和反应停止的时间数据如下表:
|
时间 H2O2 | 0.1 g | 0.3 g | 0.8 g |
| 10 mL 1.5% | 223 s | 67 s | 56 s |
| 10 mL 3.0% | 308 s | 109 s | 98 s |
| 10 mL 4.5% | 395 s | 149 s | 116 s |
请回答下列问题:
(1)盛装双氧水的化学仪器名称是 。
(2)如何检验该套装置的气密性 。
(3)相同浓度的过氧化氢,其分解速率随着二氧化锰用量的增加而________。
(4)从实验效果和“绿色化学”的角度考虑,双氧水的浓度相同时,加入________g的二氧化锰为较佳选择。
(5)某同学分析上述数据后认为:“当用相同质量的二氧化锰时,双氧水的浓度越小,所需要的时间就越少,亦即其反应速率越快”的结论,你认为是否正确________,理由是_______________________________________。(提示:H2O2的密度可认为近似相等)。
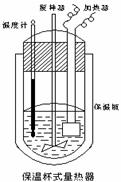 (Ⅱ)在如图所示的量热计中,将100mL 0.50mol·L-1CH3COOH溶
(Ⅱ)在如图所示的量热计中,将100mL 0.50mol·L-1CH3COOH溶
液与100mL0.55mol·L-1NaOH 溶液混合,温度从25.0℃升高到27.7℃。已知量热计的热容常数(量热计各部件每升高1℃所需的热量)是
150.5J·℃-1生成溶液的比热容为4.184J·g-1·℃-1,溶液的密度均近似
为1g·mL-1。
(1)试求CH3COOH的中和热△H= 。
(2)CH3COOH的中和热的文献值为56.1KJ· mol-1,则请你分
析在(1)中测得的实验值偏差可能的原因 。
(3)实验中NaOH过量的目的是 。
【知识点】化学实验操作 F1 G2 G5
【答案解析】22、
(Ⅰ)(1)分液漏斗 1分
(2)关闭分液漏斗的活塞,将注射器的活栓向外拉出一段距离,若一段时间后活栓能够恢复到原位置,则装置的气密性好。 2分
(3)加快 1分
(4)0.3 1分
(5)不正确 1分
H2O2的浓度扩大二倍(从1.5%—→3.0%),但反应所需时间比其二倍小的多 2分
(Ⅱ)(6)—53.3kJ/mol 2分
(7)①量热计的保温瓶绝热效果不好;②酸碱溶液混合不迅速;③温度计不够精确等2分
(8)使碱稍稍过量,为了能保证CH3COOH溶液完全被中和,从而提高实验的准确度。2分
解析:I、(1)常考实验仪器,分液漏斗便于控制反应发生
(2)检验气密性为常考点,注意书写步骤
(3)根据表格横行可知,二氧化锰用量增加,分解速率加快
(4)选择0.3g二氧化锰,因为速率加快且催化剂量适量
(5)反应速率比较的是变化量,H2O2的浓度扩大二倍(从1.5%—→3.0%),但反应所需时间比其二倍小的多
II、:(1)CH3COOH的中和热Q=△H=Q=-cm△T=[150.5J·℃-1+4.184J·g-1·℃-1×1g·mL-1×200ml]×(27.7℃-25℃)/0.05mo=-53.3 kJ•mol-1
(2)实验值偏差可能是因为①量热计的保温瓶绝热效果不好;②酸碱溶液混合不迅速;③温度计不够精确等
(3) 酸和碱反应测中和热时,为了保证一方全部反应,往往需要另一试剂稍稍过量,减少实验误差
【思路点拨】本题考查学生中和热的测定知识,注意稀的强酸和强碱溶液发生中和反应生成1mol水所放出的热量即为中和热.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下图是元素周期表短周期的一部分,下列说法正确的是
A.元素①于第二周期第IVA族 B.气态氢化物的稳定性:④>②
C.单质⑤遇足量元素①的氢化物有白烟 D.元素的最高正化合价:③=⑤

查看答案和解析>>
科目:高中化学 来源: 题型:
等体积等物质的量浓度的MOH强碱溶液和HA弱酸溶液混合后,混合溶液中有关离子浓度关系正确的是( )
A.c(M+)>c(OH-)>c(A-)>c(H+)
B.c(M+)>c(A-)>c(H+)>c(OH-)
C.c(M+)>c(A-)>c(OH-)>c(H+)
D.c(M+)+c(H+)>c(A-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)体积相同,浓度均为0.2 mol·L-1的盐酸和CH3COOH溶液,分别加水稀释10倍,溶液的pH分别变成m和n,则m与n的关系为________。
(2)体积相同,浓度均为0.2 mol·L-1的盐酸和CH3COOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成3,则m与n的关系为________。
(3)体积相同,pH均等于1的盐酸和CH3COOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成3,则m与n的关系为________。
(4)体积相同,pH均等于13的氨水和NaOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成9,则m与n的关系为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于各图的叙述正确的是
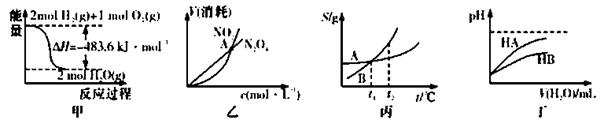
A.甲表示H2与O2发生反应过程中的能量变化,则H2的标准然烧热为△H=-241.8 kJ·mol-1
B.乙表示恒温恒容条件下发生的可逆反应2NO2(g) N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB浓液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
COCl2(g)  CO(g) + Cl2(g) ΔH > 0,当反应达到平衡时,改变一种反应条件,下列示意图正确的是
CO(g) + Cl2(g) ΔH > 0,当反应达到平衡时,改变一种反应条件,下列示意图正确的是
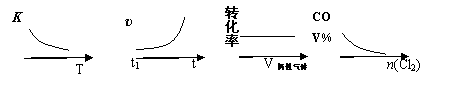
① ② ③ ④
A.①表示随温度升高,平衡常数的变化
B.②表示加入催化剂,反应速率随时间的变化
C.③表示恒压条件下,反应物的转化率随充入惰性气体体积的变化
D.④表示CO的体积分数随充入Cl2量的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g) Z(g)+W(s):△H>0下列叙述正确的是
Z(g)+W(s):△H>0下列叙述正确的是
A、加入少量W,逆反应速率增大 B、当容器中气体压强不变时,反应达到平衡
C、升高温度,平衡逆向移动 D、平衡后加入X,上述反应的△H增大
查看答案和解析>>
科目:高中化学 来源: 题型:
向某恒容密闭容器中充入一定量CO2和H2,发生反应:CO2(g)+ H2(g) HCOOH(g),测得平衡体系中CO2的百分含量(CO2%)与反应温度变化的关系如图所示。下列物理量中,a点大于b点的是
HCOOH(g),测得平衡体系中CO2的百分含量(CO2%)与反应温度变化的关系如图所示。下列物理量中,a点大于b点的是
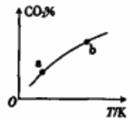
A. 正反应速率
B. 逆反应速率
C. HCOOH(g)的浓度
D. H2的体积分数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com