
| A. | ①② | B. | ②④ | C. | ③④ | D. | ①③ |
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案科目:高中化学 来源: 题型:解答题
| 实验及试剂 | 编号 | 无色NaClO3溶液用量 | 试管中溶液颜色 | 淀粉KI试纸颜色 |
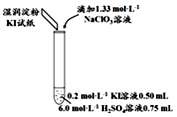 | 1 | 0.05mL | 浅黄色 | 无色 |
| 2 | 0.20mL | 深黄色 | 无色 | |
| 3 | 0.25mL | 浅黄色 | 蓝色 | |
| 4 | 0.30mL | 无色 | 蓝色 |
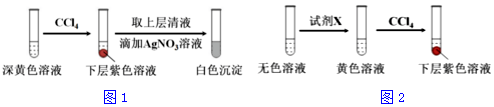
| 编号 | 6.0mol•L-1 H2SO4 溶液用量 | 试管中溶液颜色 | 淀粉KI试纸颜色 |
| 5 | 0.25mL | 浅黄色 | 无色 |
| 6 | 0.85mL | 无色 | 蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸与铜会剧烈反应,浓硝酸起到了氧化剂和酸性的作用 | |
| B. | Cl2溶于水后可以漂白有色布条,且久置后布条可以恢复原色 | |
| C. | 铁遇冷的浓硫酸钝化,说明铁和冷的浓硫酸不会发生反应 | |
| D. | NaOH可与玻璃反应,所以可以用浓NaOH溶液在玻璃上作画 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn2+HCl=ZnCl2+H2↑ | |
| B. | Cu2(OH)2CO3+4HCl=2CuCl2+CO2↑+3H2O | |
| C. | HCl+AgNO3=AgCl↓+HNO3 | |
| D. | MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na能与CuSO4溶液反应置换出红色的铜 | |
| B. | Na2O是碱性氧化物,与酸反应生成盐和水 | |
| C. | Na2O和Na2O2都能与水反应,生成物完全相同 | |
| D. | Na2O2是白色固体,可用于呼吸面具中氧气的来源 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H3PO4溶于水:H3PO4?3H++PO43- | |
| B. | (NH4)2SO4 溶于水:(NH4)2SO4═2NH4++SO42- | |
| C. | HF溶于水:HF?H++F- | |
| D. | NaHS溶于水:NaHS═Na++HS- HS-?H++S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+和Al(OH)3 | B. | Al(OH)3 | C. | AlO2-和Al(OH)3 | D. | AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
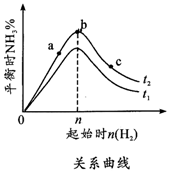 (1)在其他条件不变的情况下,起始氢气的物质的量[用n(H2)表示]对N2(g)+3H2(g) $?_{△}^{催化剂}$2NH3(g)△H<0反应的影响可表示成如图所示的规律(图中t表示温度,n表示物质的量).
(1)在其他条件不变的情况下,起始氢气的物质的量[用n(H2)表示]对N2(g)+3H2(g) $?_{△}^{催化剂}$2NH3(g)△H<0反应的影响可表示成如图所示的规律(图中t表示温度,n表示物质的量).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com