
| A. | H2、I2、HI平衡混合气体加压后颜色变深 | |
| B. | 夏天,打开冰镇啤酒瓶,立即冒出大量泡沫 | |
| C. | 生活中,用饱和碳酸钠溶液洗去锅碗瓢盆上的油污,且热溶液的效果更好 | |
| D. | 侯氏制碱工业中,降温析出副产品NH4Cl之前,向溶液中既撒NaCl固体又通入足量NH3 |
分析 勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动,使用勒夏特列原理时,该反应必须是可逆反应且存在平衡过程,否则勒夏特列原理不适用.
解答 解:A.该反应前后气体计量数之和不变,所以压强不影响平衡移动,加压后体积变小导致碘浓度增大,所以颜色加深,不能用勒夏特里原理解释,故A选;
B.开启啤酒瓶后,瓶中马上泛起大量泡沫,是压强对其影响导致的,属于可逆过程,能用勒夏特里原理解释,故B不选;
C.碳酸钠水解是可逆反应,升高温度促进碳酸钠水解导致其溶液碱性增强,所以可以用勒夏特里原理解释,故C不选;
D.氯化钠溶解度随温度变化不明显,氯化铵溶解度随温度变化较大,加入氨气促进生成氯化铵,存在可逆反应,可以用勒夏特里原理解释,故D不选;
故选A.
点评 本题考查勒夏特里原理,为高频考点,明确勒夏特里原理的适用范围是解本题关键,易错选项是A.


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:选择题
| A. | ②③④ | B. | ①③ | C. | ①②④ | D. | ①③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
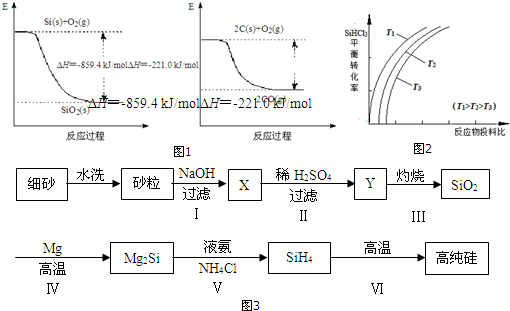
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X原子的最外层电子数比Y原子的最外层电子数多 | |
| B. | 原子半径:X>Y | |
| C. | 1mol X从酸中置换出来的氢比1mol Y从酸中置换出来的氢多 | |
| D. | X原子的最高正化合价比Y原子的最高正化合价高 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$H2O+Cu | B. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | ||
| C. | Cu+4HNO3═Cu(NO3)2+2NO2↑+2H2O | D. | CaCO3+2HCl═CaCl2+H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
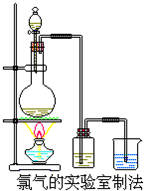 某校化学兴趣小组利用在加热条件下浓盐酸与二氧化锰的反应来制取并收集氯气,实验装置如图所示.
某校化学兴趣小组利用在加热条件下浓盐酸与二氧化锰的反应来制取并收集氯气,实验装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
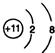 ;
; ;仅由极性键形成的非极性分子的结构式为
;仅由极性键形成的非极性分子的结构式为 ,该分子中心原子的杂化轨道类型是sp3杂化;简单氢化物的沸点最高的是H2O.
,该分子中心原子的杂化轨道类型是sp3杂化;简单氢化物的沸点最高的是H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol•L-1•min-1 | B. | 0.6mol•L-1•min-1 | ||
| C. | 1.8mol•L-1•min-1 | D. | 3.6mol•L-1•min-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com