
| A. | 均为ⅠA族元素,最外层均有1个电子 | |
| B. | 单质的还原性:Li>Na>K>Rb>Cs | |
| C. | 碱性:LiOH<NaOH<KOH<RbOH<CsOH | |
| D. | 由Li到Cs,核电荷数依次增加,电子层数、原子半径依次增大 |
分析 A.碱金属位于周期表第一主族最外层电子数为1;
B.同主族电子层数依次增加,失电子能力越来越强,还原性增强;
C.同主族电子层数依次增加,失电子能力越来越强,金属性越强形成碱的碱性越强;
D.从上到下电子层数依次增大,原子半径依次增大.
解答 解:A.碱金属位于周期表第ⅠA族,主族族序数等于原子最外层电子数,最外层电子数为1,故A正确;
B.同主族电子层数依次增加,失电子能力越来越强,还原性增强,单质的还原性:Li<Na<K<Rb<Cs,故B错误;
C.同主族电子层数依次增加,失电子能力越来越强,金属性越强形成碱的碱性越强,LiOH<NaOH<KOH<RbOH<CsOH,故C正确;
D.从上到下电子层数依次增大,核电荷数依次增加,电子层数、原子半径依次增大,故D正确;
故选B.
点评 本题考查了碱金属的递变规律分析判断,主要是周期表同主族的递变规律,掌握基础是解题关键,题目较简单.


科目:高中化学 来源: 题型:解答题
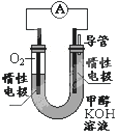 甲醇(CH3OH)是一种可再生能源,具有广泛的开发和应用前景.
甲醇(CH3OH)是一种可再生能源,具有广泛的开发和应用前景.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
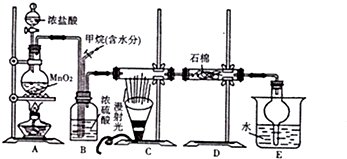
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.5mol•L-1•s-1 | B. | v(D)=0.2mol•L-1•s-1 | ||
| C. | v(C)=0.25mol•L-1•s-1 | D. | v(B)=0.3mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
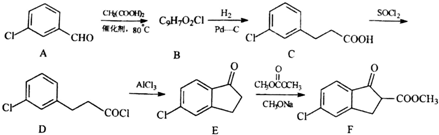
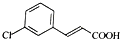 ,由D→E的反应类型是取代反应.
,由D→E的反应类型是取代反应.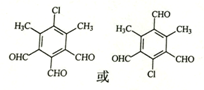 .
.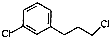 )为原料制备化合物E(
)为原料制备化合物E(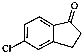 )的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
)的合成路线流程图(无机试剂任用).合成路线流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
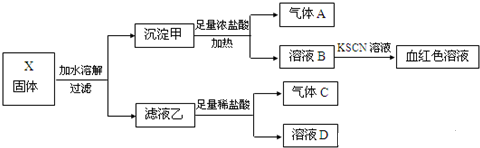
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com