
| A. | 升温 | B. | 加压 | C. | 增加D的量 | D. | 加入催化剂 |
分析 可逆反应A(g)+B(g)?2C(g)+D(s)△H<0,反应是气体体积不变的放热反应,依据化学平衡移动原理分析影响化学平衡的因素,
A.该反应为放热反应,降温平衡正向进行,升温平衡逆向进行;
B.反应前后气体体积不变,改变压强,平衡不发生移动;
C.D为固体不影响化学平衡;
D.催化剂只能改变反应速率不改变化学平衡;
解答 解:A.改变温度一定改变化学平衡,反应为放热反应,降温一定能使平衡正向进行,升温一定能使平衡向逆反应方向移动,故A正确;
B.反应前后气体体积不变,增大压强,反应速率增大,化学平衡不发生移动,故B错误;
C.D为固体不影响化学平衡,增加D的量不影响化学平衡,平衡不动,故C错误;
D.催化剂只能改变反应速率不改变化学平衡,加入催化剂平衡不移动,故D错误;
故选A.
点评 本题考查了化学平衡的影响因素分析,注意固体不影响化学平衡,温度改变一定会改变化学平衡,掌握基础是关键,题目不难.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2016-2017学年湖南省高二上第三次月考化学卷(解析版) 题型:选择题
莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中.下列关于这两种有机化合物的说法正确的是
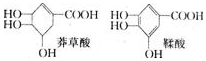
A.等物质的量的两种物质跟足量的NaOH反应,消耗NaOH的量相等
B.完全燃烧等物质的量的两种物质生成二氧化碳和水的量分别相等
C.一定条件下,两种物质都能发生酯化反应和氧化反应
D.鞣酸分子中,可能在同一平面上的原子最多有14个
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
下列说法错误的是
A.增大反应物的浓度,可增大活化分子的百分数,从而使反应速率增大
B.决定化学反应速率的主要因素是参加反应的物质的性质
C.NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g)ΔH=+185.57kJ•mol?1,能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向
D.升温能使化学反应速率增大的主要原因是增大了反应物分子中活化分子的百分数
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
如图为某化学反应速率一时间图。在t1时刻升高温度或增大压强,都符合图所示变化的 反应是 ( )
反应是 ( )
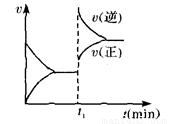
A.4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H<0
4NO(g)+6H2O(g) △H<0
B.2SO2(g)+O2(g) 2SO3(g) △H<0
2SO3(g) △H<0
C.H2(g)+I2(g) 2HI(g) △H>0
2HI(g) △H>0
D.C(s)+H2O(g) CO(g)+H2(g) △H>0
CO(g)+H2(g) △H>0
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol C(金刚石)中含有C-C键的数目为2NA | |
| B. | 当有0.4 mol Na参与反应时,被还原的CO2为0.3NA | |
| C. | 金刚石与石墨之间的转化为化学变化 | |
| D. | X的化学式为Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不变 | B. | 增大 | C. | 减小 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
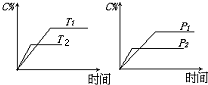 可逆反应mA(s)+nB(g)?eC(g)+fD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是( )
可逆反应mA(s)+nB(g)?eC(g)+fD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是( )| A. | 达平衡后,加入催化剂则C%增大 | |
| B. | 达平衡后,若升温,平衡向逆方向移动 | |
| C. | 化学方程式中n>e+f | |
| D. | 达平衡后,增加A的量有利于平衡向正方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaAlO2→Al(OH)3→Al | B. | N2→NO2→HNO3 | ||
| C. | NaOH→Na2CO3→NaHCO3 | D. | FeS2→SO3→H2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com