


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
| 组别 | 药品1 | 药品2 | 实验现象 |
| Ⅰ | 0.1mol/LNaOH溶液 | 0.1mol/LMgCl2溶液 | 生成白色沉淀 |
| Ⅱ | 0.1mol/L氨水 | 0.1mol/LMgCl2溶液 | 无现象 |
| Ⅲ | 1mol/L氨水 | 1mol/LMgCl2溶液 | 现象Ⅲ |
| Ⅳ | 1mol/L氨水 | 0.1mol/LMgCl2溶液 | 生成白色沉淀 |
| Ⅴ | 0.1mol/L氨水 | 1mol/LMgCl2溶液 | 无现象 |
| A、实验Ⅱ、Ⅴ无现象,而Ⅳ生成白色沉淀,说明增大c(Mg2+)不能向生成沉淀的方向移动,增大氨水溶液的浓度才能向生成沉淀的方向移动 |
| B、实验Ⅲ无现象,因为氯化镁溶液和氨水浓度都增大,则导致氯化铵浓度增大,而氢氧化镁可以溶解在氯化铵溶液中 |
| C、由于氢氧化镁可以溶解在氯化铵溶液中,而氯化镁溶液和氨水反应可以生成氯化铵,所以该两种溶液混合后可能会出现先生成沉淀后溶解的现象 |
| D、实验Ⅲ的现象是生成白色沉淀,因为增大两种溶液中任意一种的浓度,都能使混合液的离子积达到氢氧化镁的Ksp |
查看答案和解析>>
科目:高中化学 来源: 题型:
 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产.生活中有着重要作用.请回答下列问题:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产.生活中有着重要作用.请回答下列问题:| 一定条件 |
| 时间/min 浓度/mol?L-1 | c (N2) | c (H2) | c (NH3) |
| 0 | 0.6 | 1.8 | 0 |
| 3 | 0.52 | x | 0.16 |
| 6 | 0.36 | 1.08 | 0.48 |
| 9 | 0.36 | 1.08 | 0.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AgCl沉淀生成和溶解不断进行,但速率相等 |
| B、AgCl难溶于水,其溶液中没有Ag+和Clˉ |
| C、升高温度,AgCl沉淀的溶解度不变 |
| D、向AgCl沉淀中加入NaCl固体,AgCl沉淀的溶解度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
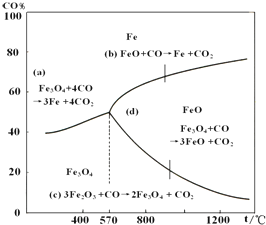 钢铁工业在我国国民经济中处于十分重要的位置,工业上采用高炉炼铁,常用赤铁矿、焦炭、空气与熔剂(石灰石)作原料.已知赤铁矿被还原剂还原是逐级进行的,还原时温度及CO、CO2平衡混合气中CO的体积分数的关系如图:
钢铁工业在我国国民经济中处于十分重要的位置,工业上采用高炉炼铁,常用赤铁矿、焦炭、空气与熔剂(石灰石)作原料.已知赤铁矿被还原剂还原是逐级进行的,还原时温度及CO、CO2平衡混合气中CO的体积分数的关系如图:查看答案和解析>>
科目:高中化学 来源: 题型:
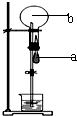 a表示胶头滴管中的液体,b表示烧瓶中的气体.不能形成喷泉实验现象的a中液体和b中气体的组合是( )
a表示胶头滴管中的液体,b表示烧瓶中的气体.不能形成喷泉实验现象的a中液体和b中气体的组合是( )| A、a-NaOH溶液、b-HCl气体 |
| B、a-NaOH溶液、b-CO2气体 |
| C、a-HCl溶液、b-NH3气体 |
| D、a-水、b-CO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 实验方案 | 实验现象 |
| ① | 向盛有少量溴化钠溶液的试管中滴加少量新制氯水,振荡,再加入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈 |
| ② | 向盛有少量碘化钠溶液的试管中滴加少量新制溴水,振荡,再加入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com