
【题目】已知常温下0.1mol/L的NH4HCO3溶液pH =7.8, 已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如下图所示。下列说法不正确的是
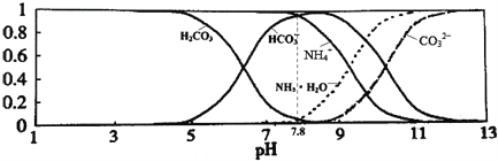
A. 溶液的pH=9时,溶液中存在下列关系:c(HCO3-)>c(NH4+)>c(NH3·H2O)>c(CO32-)
B. NH4HCO3溶液中存在下列守恒关系:c(NH4+)+c(NH3·H2O)=c(HCO3-)+c(CO32-)+c(H2CO3)
C. 通过分析可知常温下 :Kb(NH3·H2O)<Ka1(H2CO3)
D. 在此溶液中滴加少量浓盐酸,溶液中c(CO32-) / c(HCO3-)减小
【答案】C
【解析】A项,由图知溶液的pH=9时,溶液中粒子浓度由大到小的顺序为c(HCO3-)![]() c(NH4+)
c(NH4+)![]() c(NH3·H2O)
c(NH3·H2O)![]() c(CO32-),正确;B项,NH4HCO3溶液中NH4+存在水解平衡,HCO3-既存在水解平衡又存在电离平衡,则NH4HCO3溶液中的物料守恒为c(NH4+)+c(NH3·H2O)=c(HCO3-)+c(CO32-)+c(H2CO3),正确;C项,常温下0.1mol/LNH4HCO3溶液的pH=7.8,溶液呈碱性,说明HCO3-的水解程度大于NH4+的水解程度,则Kb(NH3·H2O)
c(CO32-),正确;B项,NH4HCO3溶液中NH4+存在水解平衡,HCO3-既存在水解平衡又存在电离平衡,则NH4HCO3溶液中的物料守恒为c(NH4+)+c(NH3·H2O)=c(HCO3-)+c(CO32-)+c(H2CO3),正确;C项,常温下0.1mol/LNH4HCO3溶液的pH=7.8,溶液呈碱性,说明HCO3-的水解程度大于NH4+的水解程度,则Kb(NH3·H2O)![]() Ka1(H2CO3),错误;D项,溶液中存在电离平衡HCO3-
Ka1(H2CO3),错误;D项,溶液中存在电离平衡HCO3-![]() H++CO32-,该电离平衡常数=
H++CO32-,该电离平衡常数=![]() ,溶液中滴加少量浓盐酸,c(H+)增大,电离平衡常数不变,溶液中c(CO32-)/c(HCO3-)减小,正确;答案选C。
,溶液中滴加少量浓盐酸,c(H+)增大,电离平衡常数不变,溶液中c(CO32-)/c(HCO3-)减小,正确;答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】LiFePO4电池广泛用于电动车。电池反应:FePO4+Li![]() LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含Li+导电固体为电解质。下列说法正确的是
LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含Li+导电固体为电解质。下列说法正确的是
选项 | 放电过程 | 充电过程 |
A | Li+向电池的正极迁移 | 化学能转化成电能 |
B | 可以加入磷酸以提高电解质的导电率 | 阳极的电极反应式为LiFePO4-e-=FePO4+Li+ |
C | 若正极增加7g,则有NA个电子经电解质由负极流向正极 | 阳极材料的质量不断减少 |
D | 若有n molLi+迁移,则理论负极失去nmol电子 | 阴极的电极反应式为Li++e-=Li |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中没有颜色变化的是 ( )
A.葡萄糖溶液与新制的Cu(OH)2悬浊液混合加热B.纸张上涂抹浓硫酸
C.淀粉溶液中加入碘酒D.淀粉溶液中加入稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列数据是一些有机物的相对分子质量,可能为同系物的一组是( )
A.16,32,46,60 B.16,30,42,56 C.16,28,40,52 D.16,30,58,72
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PbO(溶于酸,微溶于强碱溶液)在工业上用途广泛,可制作颜料铅白、杀虫剂等。某再生能源企业以含铅废料(主要含Pb、PbO、PbSO4和极少量的PbO2)和稀H2SO4为原料制备高纯PbO的工艺流程如下:

(1)含铅废料中的PbO2和PbSO4中,铅的化合价分别为____________、____________。
(2)酸溶过程中为了加快溶解速率,除了加入FeSO4作催化剂外,还可采取的措施有____________________(任写一种)。
(3)滤液A中含有的主要阳离子是____________________(填离子符号)。
(4)脱硫过程发生的主要反应的离子方程式为________________________________。
(5)冷却、过滤后对所得的固体进行洗涤操作,在实验室洗涤时,所用到的玻璃仪器有烧杯、_________和_________,检验沉淀是否洗涤干净的方法是________________________________。
(6)PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)![]() NaHPbO2(aq)。PbO的溶解度曲线如图所示。结合该曲线,简述由粗品PbO得到高纯PbO的操作:_______________________________。
NaHPbO2(aq)。PbO的溶解度曲线如图所示。结合该曲线,简述由粗品PbO得到高纯PbO的操作:_______________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)![]() N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是
N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是
A | B | C | D |
|
|
|
|
升高温度,化学平衡常数增大 | 0~3秒内,反应速率 V(O3)= 0.1mol·L-1·s-1 | 加入催化剂,平衡向正反应方向移动 | 达平衡时,仅改变x,则x为c(O2) |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有硫酸镁溶液500mL,它的密度是1.20g·cm3,其中镁离子的质量分数是4.8%,则有关该溶液的说法不正确的是
A. 溶质的质量分数是24% B. 溶液的物质的量浓度是2.4mol·L1
C. 溶质和溶剂的物质的量之比约为1∶21.1 D. 硫酸根离子的质量是230.4g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下提到的与盐的水解有关的说法是( )
①明矾可以做净水剂 ②实验室配制FeCl3溶液时,往往在FeCl3溶液中加入少量盐酸
③用NaHCO3和Al2(SO4)3两种溶液可作泡沫灭火剂 ④在NH4Cl溶液中加入金属镁会产生氢气
⑤草木灰与氨态氮肥不能混合施用 ⑥比较NH4Cl和Na2S等某些盐溶液的酸碱性
A. ①③⑥ B. ②③⑤ C. ③④⑤ D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2 L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。

(1)起始时X的浓度为c(X)=________;反应从开始至2分钟末,Y的转化率为α(Y)=________;用Z的浓度变化表示0~2分钟内的平均反应速率为v(Z)=________。
(2)由图中所给数据进行分析,该反应的化学方程式为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com