
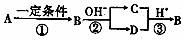 化合物A、B、C、D中均含有短周期元素X,B是一种常见的单质,它们有如图5所示的转化关系(部分产物与反应条件已略去),下列说法正确的是
化合物A、B、C、D中均含有短周期元素X,B是一种常见的单质,它们有如图5所示的转化关系(部分产物与反应条件已略去),下列说法正确的是| A. | X元素可能是金属,也可能是非金属 | |
| B. | 反应①、②、③均为氧化还原反应 | |
| C. | 反应②、③为可逆反应 | |
| D. | 若B为金属单质,反应①的“一定条件”为电解时,通常加入冰晶石作为助溶剂 |
分析 由转化关系可知B应为非金属单质,在碱性条件下发生歧化反应生成C、D两种化合物,酸性条件下C、D发生氧化还原反应又可生成B单质,则B可为Cl2、S等,以此解答该题,
解答 解:A.X不可能为金属,如为金属,能与碱反应,短周期元素只有Al符合,则C、D不可能都含有Al元素,故A错误;
B.A、C、D为化合物,B为单质,单质与化合物之间的反应存在元素化合价的变化,则一定为氧化还原反应,故B正确;
C.反应②、③在不同的条件下进行,不是可逆反应,故C错误;
D.由A的分析可知B不可能为金属单质,故D错误.
故选B.
点评 本题考查无机物的推断,为高频考点,侧重考查学生的分析能力以及元素化合物知识的综合理解和运用,注意把握常见物质的性质以及转化的特点,难度不大.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:选择题
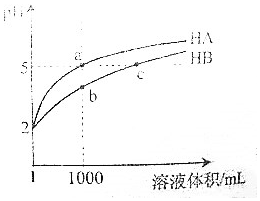 25℃时,pH=2的HA和HB各1mL分别加水稀释,pH随溶液体积变化如图所示.下列叙述正确的是( )
25℃时,pH=2的HA和HB各1mL分别加水稀释,pH随溶液体积变化如图所示.下列叙述正确的是( )| A. | Kw的数值:a点大于c点 | |
| B. | 溶液中的总酸量:a点大于b点 | |
| C. | HB的电离程度:b点大于c点 | |
| D. | 将a点与b点两溶液同时升高温度,则$\frac{c({A}^{-})}{c({B}^{-})}$减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(酸)=10V(碱) | B. | V(碱)=10V(酸) | C. | V(酸)=9V(碱) | D. | V(碱)=9V(酸) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 现使用酸碱中和滴定法测定市售白醋的总酸量(g•100mL-1).
现使用酸碱中和滴定法测定市售白醋的总酸量(g•100mL-1).| 滴定次数实验数据(mL) | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3Cl2+6FeI2═4FeI3+2FeCl3 | B. | 3Cl2+2FeI2═2FeCl3+2I2 | ||
| C. | Co2O3+6HCl═2CoCl2+Cl2↑+3H2O | D. | 2Fe3++2I-═2Fe2++I2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com