
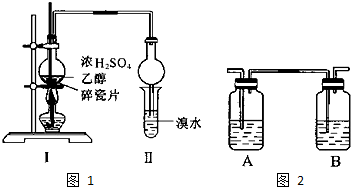
 1,2二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.189.cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.在实验室中可用下列反应制备1,2二溴乙烷.
1,2二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.189.cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.在实验室中可用下列反应制备1,2二溴乙烷.| H2SO4 |
| △ |
| ||
| ||
| ||


科目:高中化学 来源: 题型:
| A、ZnC2水解生成乙烷(C2H6) |
| B、Al4C3水解生成丙烷(C3H4) |
| C、Mg2C3水解生成丙炔(C3H4) |
| D、Li2C2水解生成乙烯(C2H4) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ⑥
⑥ ⑦
⑦ ⑧
⑧ ⑨CH3CH2CH(CH3)2 ⑩红磷
⑨CH3CH2CH(CH3)2 ⑩红磷查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 普通锌锰干电池构造如图,电池反应为:Zn+2MnO2+2NH4+═2MnO(OH)+2NH3+Zn2+.回答下列问题:
普通锌锰干电池构造如图,电池反应为:Zn+2MnO2+2NH4+═2MnO(OH)+2NH3+Zn2+.回答下列问题:
查看答案和解析>>
科目:高中化学 来源: 题型:
 的系统命名是:
的系统命名是: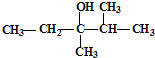 的键线式是
的键线式是 是由一种单体缩聚而成的,该单体的结构简式为
是由一种单体缩聚而成的,该单体的结构简式为查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4L CHCl3的原子总数为5NA |
| B、17g羟基(-OH)所含有的电子数是10NA |
| C、28g乙烯所含共用电子对数目为4NA |
| D、常温常压下,28g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com