
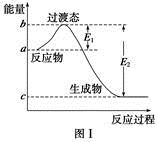

| »Æѧ¼ü | P”ŖP | P”ŖO | O===O | P===O |
| ¼üÄÜ/kJ”¤mol£1 | a | b | c | x |
 O2(g)===CO2(g)£«2H2O(l) ¦¤H£½£764.7 kJ”¤mol£1
O2(g)===CO2(g)£«2H2O(l) ¦¤H£½£764.7 kJ”¤mol£1 (d£«6a£«5c£12b)
(d£«6a£«5c£12b) P4O10£¬½įŗĻĶ¼¢ņÖŠ°×Į×¼°ĘäĶźČ«Č¼ÉÕ²śĪļµÄ½į¹¹£¬øł¾Ż”°·“Ó¦ČČ£½·“Ó¦Īļ¼üÄÜ×ÜŗĶ£Éś³ÉĪļ¼üÄÜ×ÜŗĶ”±ÓėČ¼ÉÕČČøÅÄīæɵƵȏ½£ŗ6a£«5c£(4x£«12b)£½£d£¬¾Ż“ĖæÉµĆ x=
P4O10£¬½įŗĻĶ¼¢ņÖŠ°×Į×¼°ĘäĶźČ«Č¼ÉÕ²śĪļµÄ½į¹¹£¬øł¾Ż”°·“Ó¦ČČ£½·“Ó¦Īļ¼üÄÜ×ÜŗĶ£Éś³ÉĪļ¼üÄÜ×ÜŗĶ”±ÓėČ¼ÉÕČČøÅÄīæɵƵȏ½£ŗ6a£«5c£(4x£«12b)£½£d£¬¾Ż“ĖæÉµĆ x= (d£«6a£«5c£12b)”£
(d£«6a£«5c£12b)”£


| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®»Æѧ·“Ó¦ÖŠŅ»¶ØÓŠĪļÖŹ±ä»Æ£¬µ«²»Ņ»¶ØÓŠÄÜĮæ±ä»Æ |
| B£®CaO+H2O=Ca(OH)2ŹĒ·ÅČČ·“Ó¦£¬ĖµĆ÷CaO µÄÄÜĮæ“óÓŚCa(OH)2µÄÄÜĮæ |
| C£®Ba(OH)2”¤8H2O¾§ĢåÓėĀČ»Æļ§¾§Ģå·“Ó¦²»Šč¼ÓČČ¾ĶÄÜ·¢Éś£¬ĖµĆ÷øĆ·“Ó¦ŹĒ·ÅČČ·“Ó¦ |
| D£®ÓÉH2”ś2HµÄ¹ż³ĢŠčŅŖĪüŹÕÄÜĮæ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®¢Ł¢Ü | B£®¢Ś¢Ū | C£®¢Ł¢Ü¢Ż | D£®¢Ł¢Ś¢Ü |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
 CH3OCH3(g)+H2O(g) ¦¤H="-25" kJ/mol£¬Ä³ĪĀ¶ČĻĀµÄĘ½ŗā³£ŹżĪŖ400”£“ĖĪĀ¶ČĻĀ£¬ŌŚ1 LµÄĆܱÕČŻĘ÷ÖŠ¼ÓČėCH3OH,·“Ó¦µ½Ä³Ź±æĢ²āµĆø÷×é·ÖµÄĪļÖŹµÄĮæÅضČČē±ķ£ŗ
CH3OCH3(g)+H2O(g) ¦¤H="-25" kJ/mol£¬Ä³ĪĀ¶ČĻĀµÄĘ½ŗā³£ŹżĪŖ400”£“ĖĪĀ¶ČĻĀ£¬ŌŚ1 LµÄĆܱÕČŻĘ÷ÖŠ¼ÓČėCH3OH,·“Ó¦µ½Ä³Ź±æĢ²āµĆø÷×é·ÖµÄĪļÖŹµÄĮæÅضČČē±ķ£ŗ| ĪļÖŹ | CH3OH | CH3OCH3 | H2O |
| C/(mo/L) | 0.8 | 1.24 | 1.24 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®Ļ”“×ĖįÓė0.1 mol”¤L£1 NaOHČÜŅŗ·“Ó¦£ŗH£«(aq)£«OH£(aq)===H2O(l) ¦¤H£½£57.3 kJ”¤mol£1 |
| B£®ĆܱÕČŻĘ÷ÖŠ£¬9.6 gĮņ·ŪÓė11.2 gĢś·Ū»ģŗĻ¼ÓČČÉś³ÉĮņ»ÆŃĒĢś17.6 gŹ±£¬·Å³ö19.12 kJČČĮ棬ŌņFe(s)£«S(s)==="FeS(s)" ¦¤H£½£95.6 kJ”¤mol£1 |
| C£®ĒāĘųµÄČ¼ÉÕČČĪŖ285.5 kJ”¤mol£1£¬ŌņĖ®µē½āµÄČČ»Æѧ·½³ĢŹ½ĪŖ2H2O(l)===2H2(g)£«O2(g) ¦¤H£½£«285.5 kJ”¤mol£1 |
| D£®ŅŃÖŖ2C(s)£«O2(g)==="2CO(g)" ¦¤H£½£221 kJ”¤mol£1£¬ŌņæÉÖŖCµÄČ¼ÉÕČČĪŖ110.5 kJ”¤mol£1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā

| A£®2A£«B=2C ¦¤H<0 |
| B£®2C=2A£«B ¦¤H<0 |
| C£®2A(g)£«B(g)=2C(g) ¦¤H>0 |
| D£®2A(g)£«B(g)=2C(g) ¦¤H<0 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
 O2(g)=H2O(l) ¦¤H£½£286 kJ/mol£¬ÅŠ¶ĻH2O·Ö×ÓÖŠO”ŖH¼üµÄ¼üÄÜĪŖ( )
O2(g)=H2O(l) ¦¤H£½£286 kJ/mol£¬ÅŠ¶ĻH2O·Ö×ÓÖŠO”ŖH¼üµÄ¼üÄÜĪŖ( )| A£®485£®5 kJ/mol | B£®610 kJ/mol |
| C£®917 kJ/mol | D£®1 220 kJ/mol |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā

| A£®¦¤H>0 |
| B£®XÄÜĮæŅ»¶ØøßÓŚM |
| C£®øĆ·“Ó¦ĪŖ·ÅČČ·“Ó¦ |
| D£®øĆ·“Ó¦Ņ»¶Ø²»±Ų¼ÓČČ¾ĶæÉŅŌ·¢Éś |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®ŹĶ·ÅÄÜĮæ |
| B£®·“Ó¦Īļ×ÜÄÜĮæøßÓŚÉś³ÉĪļ×ÜÄÜĮæ |
| C£®Öü“ęÄÜĮæ |
| D£®·“Ó¦Īļ×ÜÄÜĮæµĶÓŚÉś³ÉĪļ×ÜÄÜĮæ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com